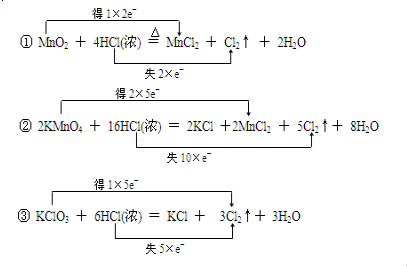
�⣺��1��MnO
2+4HCl��Ũ��

MnCl
2+Cl
2��+2H
2O���÷�Ӧ��MnO
2��MnCl
2��MnԪ����+4�ۡ�+2�ۣ�һ��MnO
2����ʧȥ2�����ӣ� HCl��Ũ����Cl
2��ClԪ����-1�ۡ�0�ۣ�����һ��Cl
2������2�� HCl����ʧȥ2�����ӣ����Ե�ʧ������С������Ϊ2��
2KMnO
4+16HCl��Ũ��=2KCl+2MnCl
2+5Cl
2��+8H
2O���÷�Ӧ��KMnO
4��MnCl
2��MnԪ����+7�ۡ�+2�ۣ�һ��KMnO
4���ӵõ�5�����ӣ�HCl��Ũ����Cl
2��ClԪ����-1�ۡ�0�ۣ�����һ��Cl
2������2�� HCl����ʧȥ2�����ӣ����Ե�ʧ������С������Ϊ10��
KClO
3+6HCl��Ũ��=KCl+3Cl
2��+3H
2O���÷�Ӧ��KClO
3��Cl
2��ClԪ����+5�ۡ�0�ۣ�һ��KClO
3���ӵ�5�����ӣ�HCl��Ũ����Cl
2��ClԪ����-1�ۡ�0�ۣ�һ��HCl����ʧȥһ�����ӣ����Ե�ʧ������С������Ϊ5��
�ʴ�Ϊ��
��
��2�������з���ʽ����HCl�ļ�����һ���ķ���ʽ���������ļ�������С��������������ɵ������࣮
��4MnO2+16HCl��Ũ��

4MnCl2+4Cl2��+8 H2O
��2KMnO
4+16HCl��Ũ��=2KCl+2MnCl
2+5Cl
2��+8H
2O
��
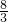
KClO
3+16HCl��Ũ��=
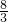
KCl+8Cl
2��+8H
2O
ͨ���Ƚϵã���ͬ��Ũ����μӷ�Ӧ�ۿ��Ƶ�����������
�ʴ�Ϊ���ۣ�
��3�����������������Ϊx��
��KClO
3+6HCl��Ũ��=KCl+3Cl
2��+3H
2O
219g 67.2L
146g x
x=
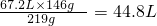
����6molHCl�μӷ�Ӧ�� 5mol������������y��������
6HCl------5HCl
��36.5��6��g ��36.5��5��g
146g y
y=

���ڱ�״���¿��Ƶ�����44.8L�������������ʵ�����Ϊ121.7g��
��������1������������ԭ��Ӧ��Ԫ�ػ��ϼ۵ı仯�������ת�Ʒ������Ŀ��
��2�������������Ȼ���֮���ϵʽ�Ƚ��жϣ�
��3�������������Ȼ���֮��Ĺ�ϵʽ���㣻���ݵ�ʧ����������ҳ�����ԭ�����Ȼ����������Ĺ�ϵ���㣮
���������⿼����˫���ŷ������ת�Ƶķ������Ŀ���й�������ԭ��Ӧ�ļ��㣬�й�������ԭ��Ӧ�ļ���ʱҪע��μӷ�Ӧ��Ũ���Ჿ�ֱ���������һ�������ᣮ

 MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O MnCl2+Cl2��+2H2O���÷�Ӧ��MnO2��MnCl2��MnԪ����+4�ۡ�+2�ۣ�һ��MnO2����ʧȥ2�����ӣ� HCl��Ũ����Cl2��ClԪ����-1�ۡ�0�ۣ�����һ��Cl2������2�� HCl����ʧȥ2�����ӣ����Ե�ʧ������С������Ϊ2��
MnCl2+Cl2��+2H2O���÷�Ӧ��MnO2��MnCl2��MnԪ����+4�ۡ�+2�ۣ�һ��MnO2����ʧȥ2�����ӣ� HCl��Ũ����Cl2��ClԪ����-1�ۡ�0�ۣ�����һ��Cl2������2�� HCl����ʧȥ2�����ӣ����Ե�ʧ������С������Ϊ2�� ��
�� 4MnCl2+4Cl2��+8 H2O
4MnCl2+4Cl2��+8 H2O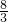 KClO3+16HCl��Ũ��=
KClO3+16HCl��Ũ��= KCl+8Cl2��+8H2O
KCl+8Cl2��+8H2O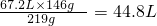




 MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O