
 能源的发展日益成为全世界、全人类共同关心的问题.
能源的发展日益成为全世界、全人类共同关心的问题.| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 899 | 1 757 | 14 840 | 21 000 |
| B | 738 | 1 451 | 7 733 | 10 540 |
| m |
| ρ |
6×2×
| ||
8×
|
| 3 |
| 1 |
| 56g/mol |
| NA/mol |
| 56 |
| NA |
| 56 |
| NA |
| 224 |
| NA |
| m |
| ρ |
| m |
| ρ |
| 224 |
| NA |
| 224 |
| aNA |
| 224 |
| aNA |
| 224 |
| aNA |


科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、充电过程中镉元素被氧化 |
| B、充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O |
| C、放电时负极附近溶液的碱性不变 |
| D、放电时电解质溶液中的OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、MnO4-、Cl-、SO42- |
| B、Na+、CO32-、Cl-、SO42- |
| C、NO3-、Na+、HCO3-、Ba2+ |
| D、Na+、NO3-、NH4+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
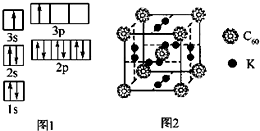
| 元素编号 | 元素性质或原子结构 |
| W | 原子电子层数与核外电子数相等 |
| X | 核外L层上s亚层的电子总数为p亚层上的电子总数的一半 |
| Y | 元素的原子半径在短周期中最大(除稀有气体外) |
| Z | 原子核外p亚层上的电子总数比s亚层上的电子总数多2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
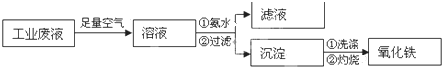
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com