
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度/(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度/(mol/L) | c1 | c2 | 0.4 |
| A、10 min内,v(Cl2)=0.04mol/(L?min) |
| B、升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大 |
| C、当容器中Cl2为1.2mol时,反应达到平衡 |
| D、平衡后移走2.0mol PCl3和1.0mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2mol/L |
| 0.4 |
| 10 |
| 0.4 |
| 10 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 减排是各个国家都在努力而为之的事,CO2和SO2的处理是许多科学家都在着力研究的重点.有学者想以下图所示装置用原电池原理将CO2、SO2转化为重要的化工原料.
减排是各个国家都在努力而为之的事,CO2和SO2的处理是许多科学家都在着力研究的重点.有学者想以下图所示装置用原电池原理将CO2、SO2转化为重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:
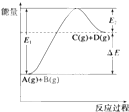 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,| A、⑤⑥⑦⑧ | B、①②③④ |
| C、①③⑤⑦ | D、②⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、观察K2SO4溶液的颜色 |
| B、向CuSO4溶液中滴加适量的NaOH溶液,振荡后静置,溶液颜色消失 |
| C、向CuSO4溶液中滴加适量的Ba(NO3)2溶液,振荡后静置,溶液颜色未消失 |
| D、加水稀释后CuSO4溶液颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl2溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- |
| B、澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| C、FeS固体放入稀硝酸溶液中:FeS+2H+═Fe2++H2S↑ |
| D、碳酸氢镁和足量的氢氧化钙溶液反应:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2NaBr+Cl2═2NaCl+Br2 |
| B、AlCl3+3NaAlO2+6H2O═4Al(OH)3↓+3NaCl |
| C、2H2S+SO2═3S↓+2H2O |
| D、2FeCl3+H2S═2FeCl2+2HCl+S↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在氧气中比在空气中燃烧得更旺 |
| B、在氧气中火焰为明亮的蓝紫色 |
| C、在氧气中反应比在空气中反应速率快 |
| D、在氧气中燃烧比在空气中燃烧放出的热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质发生化学变化时不一定都伴随能量变化 |
| B、反应热指的是反应过程中放出的热量 |
| C、在加热条件下进行的反应均为吸热反应 |
| D、相同物质的反应,当化学计量数不同时,其△H也不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com