
| A. | CuSO4溶液 | B. | 将Fe改为同质量的Na | ||
| C. | 改为用浓硫酸 | D. | NaNO3溶液 |
分析 足量的Fe与一定量的0.5mol/L盐酸反应,盐酸的量决定氢气的体积,能够加快反应速率,又不影响产生H2的总量,采取措施有:形成原电池,升高温度,改变铁的颗粒大小,增大氢离子的浓度等,据此解答.
解答 解:A、加入CuSO4,构成Fe、Cu、盐酸原电池,但氢离子的物质的量没有变化,则反应速率加快,不影响产生氢气的总量,故A正确;
B、将Fe改为同质量的Na,生成去氢气总量发生变化,故B错误;
C、改为用浓硫酸,铁与浓硫酸发生钝化,故C错误;
D、加入NaNO3溶液,Fe与硝酸根离子、氢离子发生氧化还原反应生成NO,而不生成氢气,故D错误;
故选A.
点评 本题以化学反应来考查影响反应速率的因素,明确氢离子浓度减小是减慢反应速率的关系,A选项为学生解答中的易错点.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
 研究NOX和CO等的处理方法对环境保护有重要意义.
研究NOX和CO等的处理方法对环境保护有重要意义. ①计算0~4分钟在A催化剂作用下,反应速率v(NH3)=0.25mol/(L•min).
①计算0~4分钟在A催化剂作用下,反应速率v(NH3)=0.25mol/(L•min).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
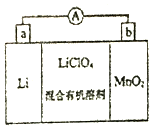 锰锂电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
锰锂电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

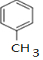 ,D中通过反应②引入的官能团名称为氯原子.
,D中通过反应②引入的官能团名称为氯原子.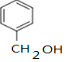 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O.
+H2O. (填结构简式).
(填结构简式).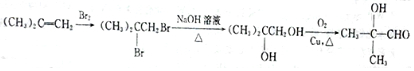 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A是气体 | B. | B是气体 | ||
| C. | 如果C是气体,A、B一定是气体 | D. | 如果C是气体,B不一定是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ | B. | HCO3- | C. | OH- | D. | Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | ① | ② | ③ | ④ |
| 科学家 | 纽兰兹 | 道尔顿 | 德贝莱纳 | 尚古尔多 |
| 工作 | 发现“八音律”,指出从某一指定的元素起,第八个元素是第一个元素的某种重复 | 创立近代原子论,率先开始相对原子质量的测定工作 | 发现了5组性质相似的“三元素组”,中间元素的相对原子质量为前后两种元素相对原子质量的算术平均值 | 认为各元素组之间并非毫不相关,可以用相对原子质量把它们按从小到大的顺序串联 |
| Ni=Co=59 | |||||
| H=1 | Cu=63.4 | Ag=108 | Hg=200 | ||
| Be=9.4 | Mg=24 | Zn=65.2 | Cd=112 | ||
| B=11 | Al=27.4 | ?=68 | Ur=116 | Au=198? | |
| C=12 | Si=28 | ?=70 | Sn=118 | ||
| N=14 | P=31 | As=75 | Sb=122 | Bi=210? | |
| O=16 | S=32 | Se=79.4 | Te=128? | ||
| F=19 | Cl=35.5 | Br=80 | I=127 | ||
| Li=7 | Na=23 | K=39 | Rb=85.4 | Cs=133 | Tl=204 |
| Ca=40 | Pb=207 |
 ,元素Z的离子结构示意图为
,元素Z的离子结构示意图为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCOOH+H2O?HCOO-+H3O+ | B. | CO2+H2O?HCO3-+H+ | ||
| C. | HCO3-+H2O?H2CO3+OH- | D. | HS-+H2O?S2-+H3O+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com