
| A. | N、O、F最高正价依次升高 | |
| B. | Al3+、Na+、O2-微粒半径依次增大 | |
| C. | F2、Cl2、Br2、I2单质的熔点逐渐降低 | |
| D. | 锂、钠、钾、铷单质与水反应置换出氢气越来越难 |
分析 A.O、F无正价;
B.具有相同电子层结构的离子中,原子序数大的离子半径小;
C.卤素单质的相对分子质量越大,熔沸点越大;
D.金属性越强,与水反应越容易.
解答 解:A.N、O、F中只有N元素有最高正价,故A错误;
B.具有相同电子层结构的离子中,原子序数大的离子半径小,则Al3+、Na+、O2-微粒半径依次增大,故B正确;
C.卤素单质的相对分子质量越大,熔沸点越大,则F2、Cl2、Br2、I2单质的熔点逐渐增大,故C错误;
D.金属性越强,与水反应越容易,则锂、钠、钾、铷单质与水反应置换出氢气越来越易,故D错误;
故选B.
点评 本题考查元素周期表和周期律的应用,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 把煤块变成煤粉燃烧更为剧烈 | |
| B. | 锌与稀硫酸反应制H2时加入少量CuSO4溶液而使反应速率加快 | |
| C. | 固态FeCl3和固态NaOH混合后,加入水能迅速产生沉淀 | |
| D. | 双氧水中加入少量MnO2,即可迅速放出气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
| 实验 编号 | 铜片 质量/g | 0.1mol•L-1 硝酸/mL | 硝酸铜 溶液/mL | 亚硝酸钠 溶液/mL | 水的体积 /mL | 实验目的 |
| ① | 5 | 20 | 0 | 0 | 0.5 | 实验①和②探究Cu2+对实验的影响;实验①和③探究亚硝酸根的影响. |
| ② | 5 | 20 | 0.5 | 0 | 0 | |
| ③ | 5 | 20 | 0 | X | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,同浓度的一元酸HA比HB易电离,则相同浓度的NaA溶液比NaB溶液的pH大 | |
| B. | 0.2 mol/LNH4NO3 和 0.l mol/L NaOH 溶液等体积混合后:c(NH4+)>c (NO3-)>c (Na+)>c (OH-)>c (H+) | |
| C. | 物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合:c (Na+)+c(H+)=c (CH3COO-)+c (OH-)+c (CH3COOH) | |
| D. | 同浓度的下列溶液:①NH4Al(SO4)2②NH4Cl ③NH3•H2O ④CH3COONH4,其中c(NH4+) 由大到小的顺序是:①>②>④>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
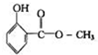 冬青油结构如图,它在一定条件下能发生的反应有:( )
冬青油结构如图,它在一定条件下能发生的反应有:( )| A. | ①②⑥ | B. | ①②③ | C. | ④⑤⑥ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
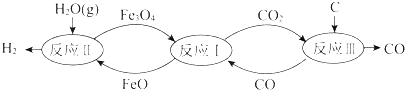
| A. | 反应Ⅰ的化学方程式是Fe3O4+CO?3FeO+CO2 | |
| B. | 反应Ⅱ的化学方程式是3FeO+H2O(g)?Fe3O4+H2 | |
| C. | 总反应的化学方程式是C+2H2O(g)?CO2+2H2 | |
| D. | 铁的氧化物是裂解水的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5g CH3+含有的电子数为NA | |
| B. | 在lL 0.lmol/L氯化铝溶液中阳离子总数大于0.lNA | |
| C. | 标准状况下,11.2L四氯化碳中含有的C-CI键的个数为2NA | |
| D. | 60g SiO2和12g金刚石中各含有4NA个Si-O键和4NA个C-C键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=12的Ba(OH)2溶液 | B. | pH=12的氨水 | ||
| C. | 0.01mol/L AgNO3溶液 | D. | 0.005mol/L NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com