
科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N
2在催化剂(掺有少量Fe
2O
3的TiO
2)表面与水发生反应,生成的主要产物为NH
3.进一步研究NH
3生成量与温度的关系,部分实验数据见下表(光照、N
2、压强1.0×10
5 Pa、反应时间3h):
| T/K | 303 | 313 | 323 | 353 |
NH3生成量
/10-6 mol | 4.8 | 5.9 | 6.0 | 2.0 |
相应的热化学方程式如下:N
2(g)+3H
2O(l)?2NH
3(g)+
O
2(g)△H=+765.2kJ?mol
-1回答下列问题:
(1)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化的示意图,并进行必要标注.
(2)与目前广泛使用的工业合成氨方法相比,该方法固氮反应速率慢.请提出可提高其反应速率且增大NH
3生成量的建议:(写两点)
;
.
(3)工业合成氨的反应为N
2(g)+3H
2(g)高温、高压催化剂
2NH
3(g).设在容积为2.0L的密闭容器中充入0.60mol N
2(g)和1.60mol H
2(g),反应在一定条件下达到平衡时,NH
3的物质的量分数(NH
3的物质的量与反应体系中总的物质的量之比)为
.
计算:①该条件下N
2的平衡转化率为
(保留一位小数).
②该条件下反应2NH
3(g)高温、高压催化剂N
2(g)+3H
2(g)的平衡常数
.
③若反应温度不变,假如在容积为2.0L的密闭容器中起始充入0.40mol N
2(g)和0.40mol H
2(g),反应3min时测得体系压强为原来的
,这段时间H
2的平均反应速率为
.

 科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3.进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2、压强1.0×105 Pa、反应时间3h):
科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3.进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2、压强1.0×105 Pa、反应时间3h):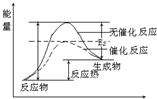 ;
;

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案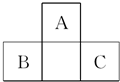 如图为短周期一部分.A、C两元素原子核外分别有两个、一个未成对电子.试回答:
如图为短周期一部分.A、C两元素原子核外分别有两个、一个未成对电子.试回答: