
| A. | 2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O (l);△H=-114.6kJ/mol | |
| B. | KOH(s)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$K2SO4(aq)+H2O (l);△H=-57.3 kJ/mol | |
| C. | 2KOH(s)+H2SO4(aq)=K2SO4(aq)+2H2O (l);△H=-114.6 kJ/mol | |
| D. | KOH(aq)+$\frac{1}{2}$ H2SO4(aq)=$\frac{1}{2}$K2SO4(aq)+H2O (l);△H=-57.3kJ/mol |
分析 根据n=$\frac{m}{M}$计算出氢氧化钾的物质的量,然后得出生成1mol水放出的热量,从而可写出中和热的热化学方程式;注意水的计量数必须为1,氢氧化钾和硫酸的状态必须为溶液(aq),据此进行解答.
解答 解:11.2gKOH的物质的量为:$\frac{11.2g}{56g/mol}$=0.2mol,0.2molKOH的稀溶液与1L、0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,实质是生成0.2mol水放出11.46kJ的热量,则生成1mol水放出的热量为:11.46kJ×$\frac{1mol}{0.2mol}$=57.3kJ,
A.中和热的热化学方程式中,水的物质的量为1mol,不是2mol,故A错误;
B.氢氧化钾的状态应该为溶液(aq),不是固体(s),故B错误;
C.氢氧化钾的状态应该为溶液(aq),且生成的水的物质的量应该为1mol,故C错误;
D.KOH的稀溶液与H2SO4稀溶液反应生成1mol水会放出57.3KJ的能量,则中和热的热化学方程式为:KOH(aq)+$\frac{1}{2}$ H2SO4(aq)=$\frac{1}{2}$K2SO4(aq)+H2O (l)△H=-57.3kJ/mol,故D正确;
故选D.
点评 本题考查中和热的概念以及热化学方程式的含义,题目难度不大,明确热化学方程式的书写原则为解答关键,注意中和热的热化学方程式中水的系数必须为1,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | Li | Be | B | C | N | O | F |
| 3 | Na | Mg | Al | Si | P | S | Cl |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A | ①能使溴的四氯化碳溶液褪色;②比例模型为 ;③能与水在一定条件下反应生成C ;③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成;②球棍模型为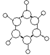 |
| C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与E反应生成相对分子质量为100的酯 |
| D | ①相对分子质量比C少2;②能由C氧化而成 |
| E | ①由C、H、O三种元素组成;②球棍模型为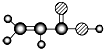 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳和水反应吸收131.3kJ 能量 | |
| B. | 1mol 碳和1mol 水反应生成一氧化碳和氢气并吸收131.3kJ 热量 | |
| C. | 1mol 固态碳和1mol 水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ | |
| D. | 1 个固态碳原子和1 分子水蒸气反应吸热131.1kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com