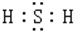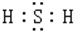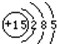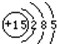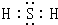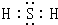【答案】
分析:(1)据核外电子层排布,画出原子的结构示意图;
(2)根据共价化合物电子式的书写方法;
(3)根据原子符号的含义;
(4)根据阳离子X
m-与阴离子Y
n+的核外电子排布相同,即电子数相同,阳离子中:核电荷数=核外电子数+所带电荷数,阴离子中,核电荷数=核外电子数-所带电荷数.
(5)用电子式表示物质的形成过程来完成;
(6)一般来说,非金属原子间形成的是共价键,金属和非金属原子形成的是离子键;
(7)根据反应热等于反应物的总键能减去生成物的总键能计算反应热.
(8)利用反应Fe+Cu
2+=Fe
2++Cu 设计原电池时,根据反应可知,铁为负极,则正极可以是活泼性不如铁的金属如Cu等,也可以是碳棒,电解质溶液应为CuSO
4,工作时,正极反应式为Cu
2++2e-=Cu,有红色金属析出,负极反应式为Zn-2e-=Zn
2+,Zn棒逐渐溶解.
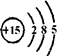
解答:解:(1)根据核外电子层排布,磷原子的结构示意图为:
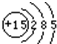
;故答案为

;
(2)H
2S为共价化合物,电子式为

,故答案为:

;
(3)因原子有8个质子,所以是氧元素,中子数为10,所以该原子表示为
818O,故答案为:
818O;
(4)因阳离子中:核电荷数=核外电子数+所带电荷数,阴离子中,核电荷数=核外电子数-所带电荷数.阳离子X
m-与阴离子Y
n+的核外电子排布相同,即电子数相同,所以a+m=b-n,即a=b-n-m,故答案为:b-n-m;
(5)氯化镁是由1个镁原子和2个氯原子通过离子键形成的,形成过程为:

,
故答案为:

(6)因过氧化钠中既有钠离子和过氧根离子之间的离子键又有氧原子和氧原子之间的共价键,故答案为:离子键,非极性键;
(7)反应的方程式为:N
2+3H
2?2NH
3,1molN
2完全反应转化为NH
3反应热为:946kJ+3×436kJ-6×391kJ=-92kJ,所以反应放出热量,故答案为:放出;92;
(8)工作时,正极反应式为Cu
2++2e-=Cu,负极反应式为Zn-2e-=Zn
2+,故答案为:Fe-2e
-═Fe
2+; Cu
2++2e
-═Cu
点评:本题考查的知识点较多,但难度不大,在解题时要认真审题,防止答非所问.

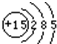 ;故答案为
;故答案为 ;
;  ,故答案为:
,故答案为: ;
; ,
,