
| A. | 2mol A+1mol B | |
| B. | 1mol C+1mol D | |
| C. | 2mol C+2mol D | |
| D. | 0.5mol A+0.5mol B+0.5mol C+1mol D |
分析 保持温度、容器容积不变条件下,按照一定的配比将物质放入容器中,达平衡时C的含量仍为m%的,说明新的平衡与原平衡为等效平衡;只要按照化学计量数将各物质转化成反应物,满足n(A)=1mol、n(B)=1mol,则两个平衡互为完全等效平衡,则达到平衡时C的含量仍为m%.
解答 解:该反应在恒温恒容下,达到平衡后,C的含量仍为m%,说明两反应为等效平衡,只要按照按化学计量数将各物质的量转化到左边,满足n(A)=1mol,n(B)=1mol即可,
A.2molA和1molB,与1molA和1molB相比,A的物质的量多了1mol,平衡向着正向移动,则达到平衡时C的含量大于m%,故A错误;
B.1molC和1molD,按照化学计量数转化成反应物,相当于加入了0.5molA、0.5molB和0.5molC,与原反应中1molA、1molB不互为等效平衡,达到平衡时C的含量不是w%,故B错误;
C.2molC和2molD,按照化学计量数转化成反应物,相当于加入了1molA、1molB、1molC,和起始量不同,达到平衡时C的含量不是w%,故C错误;
D.0.5mol A+0.5mol B+0.5mol C+1mol D,按照化学计量数转化成反应物,相当于1molA、1molB,两个平衡为完全等效平衡,达到平衡时C的含量一定为m%,故D正确.
故选D.
点评 本题考查化学平衡的有关计算、等效平衡判断,题目难度中等,构建平衡建立的途径是解题关键,注意等效平衡规律:恒温恒压下,按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡;恒温恒容下,若反应前后气体气体发生变化,按化学计量数转化到一边,满足对应物质的物质的量相等,为等效平衡;若反应前后气体的体积不变,按化学计量数转化到一边,满足对应物质的物质的量之比相同,为等效平衡.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:填空题

 (1)FeCl3具有净水作用,但腐蚀设备,FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)2Fe3++Fe=3Fe2+.
(1)FeCl3具有净水作用,但腐蚀设备,FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)2Fe3++Fe=3Fe2+.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
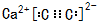 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | ① | ② | ③ | ④ |
| M(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| M(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 128gC60中含有90NA个分子 | |
| B. | 46g NO2和N2O4的混合气体含有的原子数为3NA | |
| C. | 标准状况下,22.4L CCl4所含的分子数为6.02×1023 | |
| D. | 100mL0.1 mol•L-1CaCl2溶液中Cl-的物质的量浓度为0.01 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
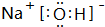 ,其中存在的化学键类型为离子键、共价键.
,其中存在的化学键类型为离子键、共价键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com