
请完成下列问题(不考虑氢、氧的氧化还原):

铅蓄电池示意图
(1)放电时:正极的电极反应式是____________;负极的电极反应式是____________________ _____________________________________________________________________。
(2)电解液中H2SO4的浓度将变__________;当外电路通过1 mol电子时,理论上负极板的质量增加__________g。
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
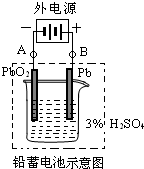
 铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO2-4
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO2-4| 放电 | 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
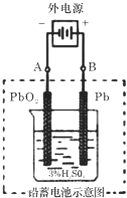
 铅蓄电池是典型的可充型电池,它的正负极是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-?2PbSO4+2H2O
铅蓄电池是典型的可充型电池,它的正负极是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-?2PbSO4+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:
 铅蓄电池是典型的可充型电池,它的正负极极板是惰性材料,电池总反应式为:
铅蓄电池是典型的可充型电池,它的正负极极板是惰性材料,电池总反应式为:| 放电 | 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
2- 4 |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省鹤岗一中高一下学期期中考试化学试卷(带解析) 题型:填空题
(8分)铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为: w.w.w.zxxk.c.o.m
w.w.w.zxxk.c.o.m
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O
放电时正极的电极反应式是________________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加______g,消耗H2SO4物质的量________ mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com