
| A. | HCl | B. | NaOH | C. | Na2SO4 | D. | NaCl |
分析 A.电解盐酸,发生反应:2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑,溶液中HCl浓度降低;
B.电解NaOH溶液,发生反应:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,溶液中NaOH浓度增大;
C.电解Na2SO4溶液,发生反应:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,Na2SO4浓度增大,但Na2SO4溶液为中性;
D.电解NaCl溶液,发生反应:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,有NaOH生成.
解答 解:A.电解盐酸,发生反应:2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑,溶液中HCl浓度降低,酸性减弱,溶液pH增大,故A错误;
B.电解NaOH溶液,发生反应:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,溶液中NaOH浓度增大,碱性增强,溶液pH增大,故B错误;
C.电解Na2SO4溶液,发生反应:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,Na2SO4浓度增大,但Na2SO4溶液为中性,溶液pH不变,故C正确;
D.电解NaCl溶液,发生反应:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,有NaOH生成,碱性增强,溶液pH增大,故D错误,
故选:C.
点评 本题考查电解原理,难度不大,关键是明确离子放电顺序及电极反应,有利于基础知识的巩固.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Na+的结构示意图为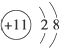 | |
| B. | 明矾的化学式为KAl(SO4)2•12H2O | |
| C. | 某微粒的电子数等于质子数,则该微粒可能是分子或离子 | |
| D. | 化学变化不产生新元素,产生新元素的变化不是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
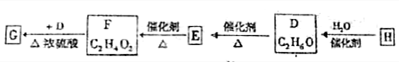

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将一定量KAl(SO4)2溶液和一定量Ba(OH)2溶液混合,沉淀的质量恰好最大时:Al3++2SO42-+3OH-+2Ba2+═2BaSO4↓+Al(OH)3↓ | |
| B. | 向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+ | |
| D. | 用Al(OH)3中和过多的胃酸:Al(OH)3+3H+═Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
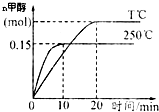 将1molCO和2molH2充入一容积为1L的密闭容器中,分别在250℃、T℃发生反应:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol,根据图示判断,下列结论正确的是( )
将1molCO和2molH2充入一容积为1L的密闭容器中,分别在250℃、T℃发生反应:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol,根据图示判断,下列结论正确的是( )| A. | a<0,T<250 | |
| B. | 250℃时,0~10min内:v(H2)=0.015mol/(L•min) | |
| C. | CO的平衡转化率在250℃时比T℃大 | |
| D. | 250℃时,起始时向容器中改充1molCH3OH气体,恒温达平衡后,CH3OH的物质的量大于0.15mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
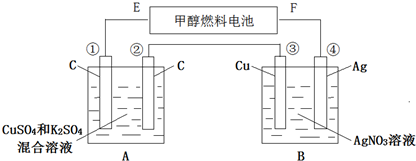
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:3:2 | B. | 5:5:4 | C. | 2:2:3 | D. | 1:1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com