
【题目】用无水Na2CO3配制250 mL 1.000 mol·L-1 Na2CO3溶液时,下列操作会使配制的溶液浓度偏大的是
A.称量时碳酸钠固体含有结晶水B.溶液未冷却立即定容
C.定容时俯视容量瓶刻度线D.容量瓶没有干燥
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】现有三个热化学方程式:
(1)CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
(2)C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
(3)H2(g)+![]() O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( )
A. -488.3 kJ/mol B. +488.3 kJ/mol
C. -2 228.9 kJ/mol D. +191 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、燃料、香料等工业,在中学化学实验室里常用下图装置来制备乙酸乙酯。(部分夹持仪器已略去)

已知:

制备粗品(图1)
在A 中加入少量碎瓷片,将三种原料依次加入A 中,用酒精灯缓慢加热,一段时间后在B 中得到乙酸乙酯粗品。
①浓硫酸、乙醇、乙酸的加入顺序是________________________________________,A 中发生反应的化学方程式是__________________________________________。
②A 中碎瓷片的作用是_____________________________________,长导管除了导气外,还具有的作用是_____________________________。
③B 中盛装的液体是_____________________,收集到的乙酸乙酯在_________层(填“上”或“下”)。
制备精品(图2)
将B 中的液体分液,对乙酸乙酯粗品进行一系列除杂操作后转移到C 中,利用图2 装置进一步操作即得到乙酸乙酯精品。
①C 的名称是___________________。
②实验过程中,冷却水从_________口进入(填字母);收集产品时,控制的温度应在________℃左右。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库。下图是人类从海水资源获取某些重要化工原料的流程示意图。
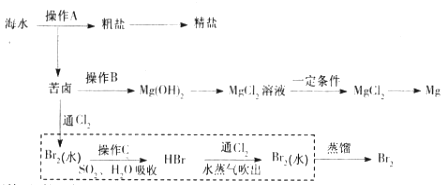
回答下列问题:
(1)操作A是_______________(填实验基本操作名称)。要知道海水晒盐的过程中溶液里食盐含量在逐渐提高的简易方法是__________________。
a.分析氯化钠含量 b.测定溶液密度 c.观察是否有沉淀析出
(2)操作B需加入下列试剂中的一种,最合适的是_____________。
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳d.碳酸钠溶液
(3)上图中虚线框内流程的主要作用是_____________。写出溴水中通入SO2时反应的离子方程式____________
(4)上图中虚线框内流程也可用![]() Br2与Na2CO3反应的化学方程式补充完整:
Br2与Na2CO3反应的化学方程式补充完整:
![]() ___________
___________
(5)已知苦卤的主要成分如下:

理论上,1 L苦卤最多可得到Mg(OH)2的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对文中描述内容的相关解释正确的是( )
选项 | 描述 | 解铎 |
A | 丹砂烧之成水银,积变又还成丹砂 | 两个反应互为可逆反应 |
B | 凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之 | 其中“瓦”的主要成分为硅酸盐 |
C | 硝石(KNO3)如握盐雪不冰,强烧之,紫青烟起 | 产生“紫青烟”的原因为KNO3分解 |
D | 其法用浓酒精和槽入瓶,蒸令气上,用器承滴露 | 其中涉及的操作方法为蒸发浓缩 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂空气电池放电时的工作原理如下图所示。下列叙述正确的是( )
A. 放电时Li+由B极向A极移动
B. 电池放电反应为4Li+O2+2H2===4LiOH
C. B电极反应式为O2+4e-===2O2-
D. 电解液a可以为氯化锂溶液
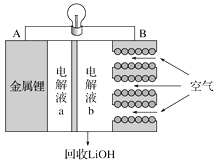
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化如图所示。
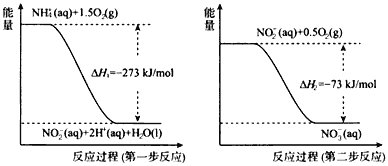
①第一步反应是____(填“放热”或“吸热”)反应。
②1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是______。
(2)已知,H2(g)+Br2(l)=2HBr (g) △H=-72kJ/mol,蒸发1molBr2(l)需要吸收的能量为30kJ,其它相关数据如下表:
物质 | H2(g) | Br2(g) | HBr (g) |
1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
则表中a为_____。
(3)研究NO2、SO2 、CO等大气污染气体的处理方法具有重要的意义。
已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH= -196.6 kJ·mol-1
2SO3(g) ΔH= -196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH= -113.0 kJ·mol-1
2NO2(g) ΔH= -113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=____kJ·mol-1;
SO3(g)+NO(g)的ΔH=____kJ·mol-1;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3A(g)+2B(g)![]() 2C(g)+3D(g)。在温度和体积都相同的条件下分别建立两个平衡:①.A、B的起始物质的量为3mol和2mol,②.C、D的起始物质的量分别为4mol和6mol。四个选项中错误的是( )
2C(g)+3D(g)。在温度和体积都相同的条件下分别建立两个平衡:①.A、B的起始物质的量为3mol和2mol,②.C、D的起始物质的量分别为4mol和6mol。四个选项中错误的是( )
A. 达平衡时,①途径的反应速率vA不等于②途径的反应速率vA
B. ①、②都达到平衡时,体系内混合气体的平均相对摩尔质量相同
C. ①、②都达到平衡时,体系内混合气体的组成百分比相同
D. 达平衡时,①途径所得混合气的密度为②途径所得混合气密度相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com