
| A. | 实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量 Cu(NO3)2溶液 | |
| B. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,平衡时氢气转化率增大 | |
| C. | 吸热反应“TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反 应的△S<0 | |
| D. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
分析 A.硝酸为氧化性酸,与金属反应不生成氢气;
B.正反应为放热反应,升高温度平衡逆向移动,反应物转化率降低;
C.正反应为吸热反应,则△H>0,而△H-T△S<0反应自发进行;
D.根据溶度积转化为碳酸钙沉淀,再利用盐酸与碳酸钙反应.
解答 解:A.加入硝酸铜,溶液中硝酸为氧化性酸,与金属反应不生成氢气,故A错误;
B.正反应为放热反应,升高温度平衡逆向移动,氢气转化率减小,故B错误;
C.正反应吸热反应,则△H>0,在一定条件下可自发进行,则△H-T△S<0反应自发进行,若△S<0,则△H-T△S>0,反应不能自发进行,正反应为气体物质的量减小的反应,则△S<0,故C错误;
D.利用饱和碳酸钠溶液,根据溶度积将硫酸钙转化为碳酸钙沉淀,而盐酸与碳酸钙反应,故D正确,
故选:D.
点评 本题考查化学反应速率影响因素、化学平衡影响因素、反应自发性、沉淀转化、元素化合物性质等,A选项为易错点,学生容易考虑形成原电池加快反应速率,而忽略硝酸为氧化性酸.


科目:高中化学 来源: 题型:选择题
| A. | 用灼烧的方法鉴别羊毛线和棉线 | |
| B. | 分馏石油时,温度计的水银球必须插入液面下 | |
| C. | 做银镜反应实验后,试管壁上的银镜用硝酸洗涤 | |
| D. | 沾附在试管内壁上的油脂,用热碱液洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的NaHSO4与Ba(OH)2溶液的反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| C. | 酸性条件下KIO3和KI溶液反应生成I2:IO3-+5I-+3H2O═3I2+6 OH- | |
| D. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
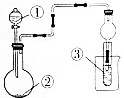 利用如图所示装置进行下列实验,不能得出相应实验结论的是( )
利用如图所示装置进行下列实验,不能得出相应实验结论的是( )| 选项 | ① | ② | ③ | ③中的现象 |
| A | 浓盐酸 | Na2SO3 | BaCl2溶液 | 出现浑浊 |
| B | 稀盐酸 | 石灰石 | 饱和Na2CO3溶液 | 出现浑浊 |
| C | 浓氨水 | 生石灰 | 酚酞溶液 | 出现红色 |
| D | 醋酸 | 贝壳 | 澄清石灰水 | 先浑浊后澄清 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 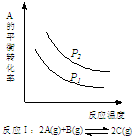 反应:△H>0,P2>P1 | B. | 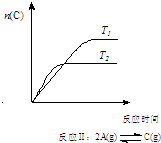 反应:△H<0,T1<T2 | ||
| C. | 反应:△H>0,T2>T1;或△H<0,T2<T1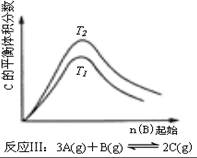 | D. | 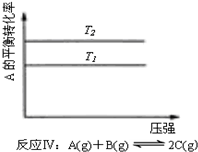 反应:△H<0,T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 节约能源,提高能源利用率 | |
| B. | 大量开采化石原料,以满足社会对能源的要求 | |
| C. | 减少直至不使用对大气臭氧层起破坏作用的氟氯烃 | |
| D. | 采用“绿色化学”工艺,使原料尽可能转化为所需要的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气有毒,可以毒死细菌、病毒 | |
| B. | 氯气具有刺激性气味,可以熏死细菌、病毒 | |
| C. | 氯气与水反应生成具有强氯化性的HClO,可以杀死细菌、病毒 | |
| D. | 氯气用于自来水消毒没有任何有毒物质残留 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
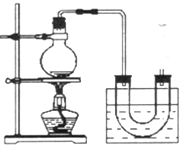 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:
实验室制备溴乙烷(C2H5Br)的装置和步骤如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com