
工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下图:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
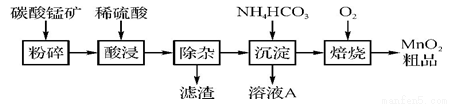
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Pb(OH)2 | Mn(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 8.0 | 8.3 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.8 | 9.8 |
问答下列问题:
(1) 酸浸前将碳酸锰矿粉碎的作用是 。
(2) 酸浸后的溶液中含有Mn2+、SO42-,另含有少量Fe2+、Fe3+、Al3+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其反应的离子方程式为 。
②加入CaO将溶液的pH调到5.2~6.0,其主要目的是 。
③加入BaS,除去Cu2+、Pb2+后,再加入NaF溶液,除去 。
(3) 从溶液A中回收的主要物质是 ,该物质常用作化肥。
(4) MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2。写出Mn3O4与稀硫酸反应的化学方程式: 。
科目:高中化学 来源:2016-2017学年江西省高一上第一次月考化学卷(解析版) 题型:填空题
现有一定体积的HCl气体,将其溶于100mL稀硫酸中,假设溶液的体积不变,向混合溶液中加入4mol•L-1的NaOH溶液10mL恰好呈中性.继续向所得中性溶液中滴入过量的Ba(OH)2 溶液,所得沉淀质量为2.33g.
(1)生成沉淀的化学方程式为_________________________.
(2)硫酸的物质的量浓度: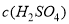 =____________________________.
=____________________________.
(3)该HCl气体在标准状况下的体积为_____________mL.
(4)若向该混酸溶液(仍为100mL)中加入Na2CO3•10H2O晶体,直到不再产生气体时为止,消耗Na2CO3•10H2O晶体的质量为____________g
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学卷(解析版) 题型:选择题
下列对实验过程的评价正确的是
A.某固体加入稀盐酸,产生了无色气体,证明该固体一定是碳酸盐
B.某溶液中滴加BaCl2溶液,生成不溶于稀HNO3的白色沉淀,该溶液中一定含SO42-
C.某无色溶液中滴入无色酚酞显红色,该溶液一定显碱性
D.验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加AgNO3溶液,有白色沉淀出现,证明含Cl-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆一中高一上10月月考化学试卷(解析版) 题型:选择题
下列反应中,加入氧化剂才能实现的是( )
A.CO32-→CO2 B.HCl→Cl2 C.Cl2→HCl D.KMnO4→MnO2
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:填空题
原子序数依次增加的X、Y、Z、W四种元素原子序数均小于36, Y基态原子最外层电子数是其内层电子总数的3倍,X、W基态原子是同周期元素中未成对电子数最多的原子,X与Z的原子核内质子数之和等于W原子核内质子数,Z基态原子只有1个未成对的电子。
回答下列问题:
(1)已知化合物XZ3与H2Y(Y的氢化物)发生反应的化学方程式为XZ3+H2Y→XH3+HZY,则元素的电负性:Y Z(填“大于”或“小于”),化合物HZY分子的空间构型为 。
(2)X的一种氢化物的相对分子质量为32,1mol该氢化物中的σ键数是 ,该氢化物在水中的溶解性如何?主要原因是什么?
(3)元素Y 3个原子形成的单质分子与元素X、Y形成的一种离子互为等电子体,这种离子的化学式是 。
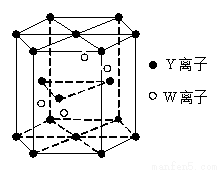
(4)基态W原子的电子排布式是 ,元素Y和W的一种化合物的晶体结构如右图所示,该晶体的化学式为 。(W处于晶体内部,Y分别处于晶胞面心、顶点、和内部)
(5)金属原子 (选填“钾”、“镁”、“铜”)形成的晶体的堆积方式,与上述晶胞中Y离子的堆积方式相同。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:选择题
红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构如下图所示。
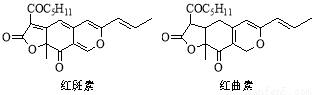
下列说法正确的是
A.红斑素和红曲素互为同分异构体
B.红斑素和红曲素都能与NaOH溶液反应
C.红斑素中含有醚键、羰基等三种含氧官能团
D.1 mol红曲素最多能与6 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.澄清透明的溶液中:Na+、K+、MnO4-、AlO2—
B.滴入酚酞呈无色的溶液中:K+、HCO3-、Cl-、CO32-
C.c(OH-)/c(H+)=1012的溶液中:SO32-、NH4+、NO3-、K+
D.c(I-)=0.1 mol·L-1的溶液中:Na+、NH4+、ClO-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 ,其原子核外共有22种运动状态不相同的电子.金属钛的晶胞结构如图1所示,其堆积方式为六方最密堆积.
,其原子核外共有22种运动状态不相同的电子.金属钛的晶胞结构如图1所示,其堆积方式为六方最密堆积.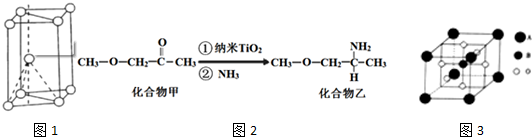
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋的主要成分是乙酸,可同时用作防腐剂和调味剂 | |
| B. | 亚硝酸钠可能致癌,人们应尽量少吃腌制食物 | |
| C. | 我国应禁止使用味精,避免它对人体健康的损害 | |
| D. | 营养强化剂是补充食品中缺乏的营养成分或微量元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com