
| A. | 3:11 | B. | 11:3 | C. | 2:3 | D. | 4:3 |
分析 Cl2生成ClO-与ClO3-是被氧化的过程,Cl2生成NaCl是被还原的过程,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,根据ClO-与ClO3-的物质的量浓度之比可计算失去电子的总物质的量,进而可计算得到电子的总物质的量,可计算被还原的氯元素的物质的量,则可计算被还原的氯元素和被氧化的氯元素的物质的量之比.
解答 解:Cl2生成ClO-与ClO3-是被氧化的过程,化合价分别由0价升高为+1价和+5价,
ClO-与ClO3-物质的量之比为1:2,
则可设ClO-为1mol,ClO3-为2mol,被氧化的Cl共为3mol,
失去电子的总物质的量为1mol×(1-0)+2mol×(5-0)=11mol,
氧化还原反应中氧化剂和还原剂之间得失电子数目相等,
Cl2生成KCl是被还原的过程,化合价由0价降低为-1价,
则得到电子的物质的量也应为11mol,
则被还原的Cl的物质的量为11mol,
所以应中被氧化的Cl2与被还原的Cl2物质的量之比为3mol:11mol=3:11,
故选A.
点评 本题考查氧化还原反应的计算,题目难度中等,解答时注意从氧化还原反应中氧化剂和还原剂之间得失电子数目相等的角度计算,注意守恒法在化学计算中的应用方法.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
| O2 | Na2CO3 | CO2 | 转移电子数 | |
| A | 1mol | 0.5NA | ||
| B | 0.5mol | 11.2L | ||
| C | 0.25mol | 53g | ||
| D | 8g | NA |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Bi元素的质量数是209 | |
| B. | Bi元素最高价氧化物的化学式为Bi2O3 | |
| C. | Bi元素位于元素周期表第六周期第VA族 | |
| D. | Bi为放射性元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
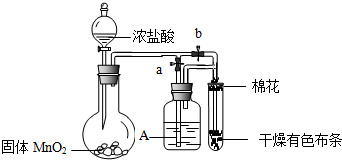
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤油可用作燃料或保存少量金属钠 | |
| B. | 淀粉和蛋白质都能水解,但水解产物不同 | |
| C. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| D. | 油脂里饱和烃基的相对含量越大,油脂的熔点越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +4NaOH$→_{△}^{醇溶液}$NaOOCC≡CCOONa+2NaBr+4H2O.
+4NaOH$→_{△}^{醇溶液}$NaOOCC≡CCOONa+2NaBr+4H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
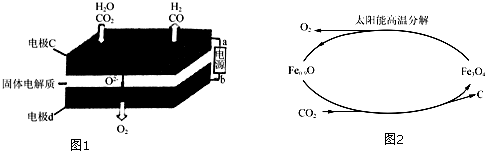

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol | B. | 2mol | C. | 2.5mol | D. | 10mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com