
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
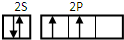 ,根据元素周期律,碳的电负性比氧的小;由于氧的非金属性强于碳,所以水的稳定性强于甲烷,故答案为:
,根据元素周期律,碳的电负性比氧的小;由于氧的非金属性强于碳,所以水的稳定性强于甲烷,故答案为: ;小;H2O.
;小;H2O.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| △ |
| △ |
| △ |
| △ |

| 操作 | 预期实验现象和结论 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
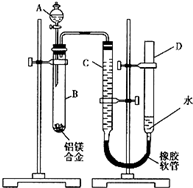 含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料.现有一块已知质量为m1g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料.现有一块已知质量为m1g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:| 足量的NaOH溶液 |
| 足量盐酸 |
| () |
| () |
查看答案和解析>>
科目:高中化学 来源: 题型:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.试判断相同条件下B4与B2的稳定性顺序是:
,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.试判断相同条件下B4与B2的稳定性顺序是:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com