
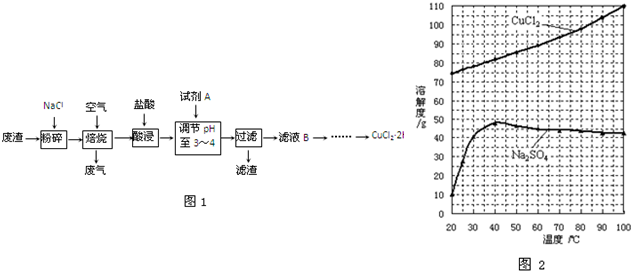
| ||
| ʵ����� | 1 | 2 | 3 | 4 |
| ����Na2S2O3����Һ��mL�� | 25.00 | 25.02 | 26.20 | 24.98 |

| 25.00+25.02+24.98 |
| 3 |
| 250 |
| 25 |
| 0.02mol��171g/mol |
| ag |
| 342 |
| a |
| 342 |
| a |
 ��
�� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2 mol/L |
| B��1 mol/L |
| C��0.4 mol/L |
| D��0.2 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
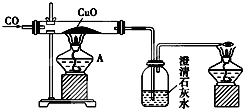 ��ͼ�Ǽ�ͬѧ��Ƶ�֤��CO���л�ԭ�Ե�ʵ��װ�ã��ش��������⣺
��ͼ�Ǽ�ͬѧ��Ƶ�֤��CO���л�ԭ�Ե�ʵ��װ�ã��ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 3 |
| 4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʱ�䣨min�� | 0 | 15 | 30 | 45 | 60 | 90 | 120 | |
| ��ֽ ���� ��ɫ �仯 | ����ƬI�ϵ���ֽ�� | ��ɫ | ��ɫ | ��ɫ | dz��ɫ | ��ɫ | ��ɫ | dz��ɫ |
| ����ƬII�ϵ���ֽ�� | ��ɫ | ��ɫ | ��ɫ | ��ɫ | ��ɫ | ��ɫ | dz��ɫ | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���о��ɽ���߷��Ӳ��ϣ�����ʹ��������Ʒ |
| B��������̼���ã����ٶԻ�ʯȼ�ϵ����� |
| C��ͨ��ȼú��������β��������߿������� |
| D������¶����ջ�����ķ��������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����H1=-178.32 kJ?mol-1��H2=-78.3 kJ?mol-1 |
| B����H1=+178.32 kJ?mol-1��H2=-78.3 kJ?mol-1 |
| C����H1=-178.32 kJ?mol-1��H2=+78.3 kJ?mol-1 |
| D����H1=+178.32 kJ?mol-1��H2=+78.3 kJ?mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com