
| A. |  酒精 | B. |  浓盐酸 | C. |  浓硫酸 | D. |  CO2 |
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,浓硫酸可以用铁制槽罐存放,说明铁与浓硫酸不反应 | |
| B. | 检验氯化氢中是否混有氯气,可采用湿润的有色布条 | |
| C. | 镁在空气中燃烧只生成氧化镁 | |
| D. | 钠可以从硫酸铜溶液中置换出金属铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
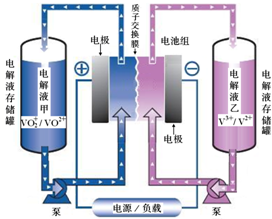 (1)全钒液流电池储能技术及应用荣获2015年国家技术发明二等奖.其结构及工作原理如图所示,电解液均呈酸性.
(1)全钒液流电池储能技术及应用荣获2015年国家技术发明二等奖.其结构及工作原理如图所示,电解液均呈酸性.| 化学式 | 电离常数 |
| HCN | K=6.2×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸钠水溶液显碱性:SO32-+2H2O?H2SO3+2OH- | |
| B. | SO2的水溶液显酸性:SO2+H2O?H2SO3?2H++SO32- | |
| C. | 燃煤时加入石灰石减少SO2排放:2CaCO3+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2 | |
| D. | 浓硫酸处理少量氨气:H2SO4+2NH3═(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质溶液的导电能力一定比弱电解质溶液强 | |
| B. | 用相同的盐酸中和体积,物质的量浓度均相同的氢氧化钠和氨水溶液,所需盐酸的量相等 | |
| C. | 将氢氧化钠和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的50% | |
| D. | 氢氧化钠溶液的物质的量浓度是氨水的两倍,则氢氧化钠的OH-浓度也是氨水溶液的两倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com