
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与盐酸完全反应(注:矿石中其他成分不与盐酸反应),生成2.4 g硫单质、0.425 mol FeCl2和一定量H2S气体,且溶液中滴加KSCN溶液不变血红色。请计算并回答下列问题:
(1)该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为_____________。
(2)该磁黄铁矿FexS中,x=_________________。
【答案】11∶6 0.85
【解析】
根据题中信息,可以推出FexS为FeS和Fe2S3的混合物;向该该磁黄铁矿中加入盐酸,发生反应FeS+2HCl=FeCl2+H2S↑,Fe2S3+4HCl=2FeCl2+2H2S↑+S↓;且反应后的溶液中滴加KSCN溶液不变血红色,说明溶液中不含Fe3+,再根据题中给出的数据分析计算即可。
根据题中信息,可以推出FexS为FeS和Fe2S3的混合物;向该该磁黄铁矿中加入盐酸,发生反应FeS+2HCl=FeCl2+H2S↑,Fe2S3+4HCl=2FeCl2+2H2S↑+S↓;根据题中信息可得,n(S)=![]() =0.075mol,n(FeCl2)=0.425mol,根据反应Fe2S3+4HCl=2FeCl2+2H2S↑+S↓可以计算得到n(Fe2S3)=0.075mol,n(FeCl2)2=0.15mol,则n(FeCl2)1=0.425mol-0.15mol=0.275mol,根据反应FeS+2HCl=FeCl2+H2S↑可以计算得到n(FeS)= n(FeCl2)1=0.275mol,则该磁黄铁矿FexS中,含0.275mol FeS和0.075mol Fe2S3,故Fe2+与Fe3+的物质的量之比为0.275mol:(2×0.075mol)=11:6;该磁黄铁矿FexS中,含Fe 0.425mol,S 0.5mol,则
=0.075mol,n(FeCl2)=0.425mol,根据反应Fe2S3+4HCl=2FeCl2+2H2S↑+S↓可以计算得到n(Fe2S3)=0.075mol,n(FeCl2)2=0.15mol,则n(FeCl2)1=0.425mol-0.15mol=0.275mol,根据反应FeS+2HCl=FeCl2+H2S↑可以计算得到n(FeS)= n(FeCl2)1=0.275mol,则该磁黄铁矿FexS中,含0.275mol FeS和0.075mol Fe2S3,故Fe2+与Fe3+的物质的量之比为0.275mol:(2×0.075mol)=11:6;该磁黄铁矿FexS中,含Fe 0.425mol,S 0.5mol,则![]() ,x=0.85。
,x=0.85。


科目:高中化学 来源: 题型:
【题目】T℃时,在恒容密闭容器中充入一定量的H2和CO,在催化剂作用下发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)△H<0。反应达到平衡时,CH3OH体积分数与
CH3OH(g)△H<0。反应达到平衡时,CH3OH体积分数与![]() 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
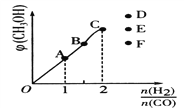
A. 反应达平衡时,升高体系温度,CO转化率升高
B. 反应达平衡时,再充入一定量Ar,平衡右移,平衡常数不变
C. 容器内混合气体的密度不再变化说明该反应达到平衡状态
D. ![]() =2.5时达到平衡状态,CH3OH的体积分数可能是图中的F点
=2.5时达到平衡状态,CH3OH的体积分数可能是图中的F点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,由CO合成甲醇:CO(g) + 2H2(g)![]() CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )

A.平衡常数K=![]()
B.该反应在T1时的平衡常数比T2时的小
C.CO合成甲醇的反应为吸热反应
D.处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某难溶性盐X(仅含三种常见元素)的组成,设计并完成以下实验(流程中部分物质已略去):

已知:气体A和气体B所含元素相同,都是无色无味气体,固体C为纯净物且具有磁性,单质D是目前建筑行业应用最广泛的金属。根据上述信息,回答下列问题:
(1)盐X的化学式为________________。
(2)无水条件下,少量NaH就能与固体C反应并放出大量的热,写出该反应的化学方程式___________________。
(3)将产生的气体A全部被100 mL 0.35 mol·L-1氢氧化钠溶液充分吸收,反应的总离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据实验方案和现象对浓硫酸性质做出的判断合理的是
实验方案 | 实验I: | 实验II: |
实验现象 | 试纸中心区域变黑,边缘变红 | 黑色固体溶解,溶液接近无色(溶液中锰元素仅以 |
A.由I可知,浓硫酸具有脱水性B.由I可知,浓硫酸具有弱酸性
C.由II可知,浓硫酸具有强氧化性D.由II可知,浓硫酸具有吸水性
查看答案和解析>>
科目:高中化学 来源: 题型:
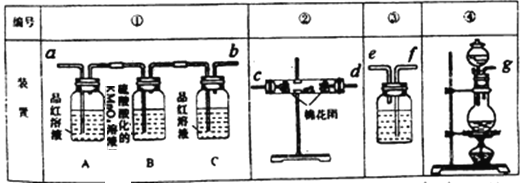
【题目】某课外小组设计了下图所示的实验装置(图中固定装置已略去),进行SO2性质的研究。

(1)从物质分类的角度,SO2属于____(填“酸性”或“碱性”)氧化物。
①图中D装置可用来验证SO2具有该性质,其中所加入的试剂是________________。
②当向该装置通入SO2时,A中实验现象为_________,用化学用语解释其原因___________。
(2)从元素化合价的角度分析,SO2具有___性。
①当向该装置通入SO2一段时间后,可观察C中实验现象为___,说明SO2具有_____性。
②如验证SO2还具有另一方面的性质,可选择的药品是___,实验现象__________。
A.过氧化氢 B.浓硫酸C.氯水 D.硫化钠溶液
(3)B中的品红溶液现象是___________,证明SO2具有_________性。
(4)多余的SO2一般用氢氧化钠溶液吸收,反应的离子方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知浓硫酸和木炭粉在加热条件下可发生化学反应。
(1)上述反应的化学方程式为_____________________
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物。
这些装置的连接顺序(按产物气流从左至右的方向)是(填装置中导管口的编号):
_________接__________ ,________接__________,___________ 接_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物W在医药和新材料等领域有广泛应用,其合成路线如图所示:

已知以下信息:
①1molY完全反应生成2molZ,且在加热条件下Z不能和新制的氢氧化铜反应
② +R1COOH
+R1COOH
③R1CH2NH2 +H2O(R1、R2、R3代表烃基)
+H2O(R1、R2、R3代表烃基)
回答下列问题:
(1)Y的化学名称是___________,Z中的官能团名称是___________。
(2) 中___________(填“有”或“无”)手性碳原子,①的反应类型是___________。
中___________(填“有”或“无”)手性碳原子,①的反应类型是___________。
(3)反应③所需的试剂和条件是___________。
(4)反应⑤的化学方程式为___________。
(5)G是对硝基乙苯的同分异构体,G能和碳酸氢钠反应产生气体且分子中含有氨基(-NH2),G的可能结构共有___________种(不考虑立体结构);其中核磁共振氢谱为五组峰,峰面积比为2:2:2:2:1的结构简式为___________。
(6)已知氨基(-NH2)易被酸性KMnO4溶液氧化。设计由甲苯和丙酮为原料制备药物中间体![]() 的合成路线:___________(无机试剂任选)。
的合成路线:___________(无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com