
分析 (1)氮原子核外电子数为7,根据能量最低原理书写最外层电子排布式;
比较非金属性的强弱,可根据最高价氧化物对应水化物的酸性强弱,与氢气反应的剧烈程度,氢化物的稳定性,单质之间的置换反应等,对应阴离子的还原性强弱等;
(2)反应中Fe元素的化合价升高,则N元素的化合价降低;维生素C可解毒,说明维生素C能把铁离子还原为亚铁离子;
(3)把新制的氯水加到NaNO2溶液中,二者发生氧化还原反应生成NaNO3和HCl;反应中1molNaNO2失去2mol电子;
(4)HNO2的电离常数大于H2CO3,则HNO2的酸性强,HNO2溶液与Na2CO3溶液等体积混合生成NaNO2和NaHCO3,二者均能水解显碱性,HCO3-的水解程度大;
解答 解:(1)氮原子核外电子数为7,基态原子核外电子排布为1S12S22P3,故最外层电子排布式为2s22p3;
a.氢化物的稳定性越强,其非金属性越强,已知氢化物稳定性:H2O>NH3 ,则非金属性O大于N,故a正确;
b.氢化物的沸点属于物理性质,与元素的非金属性无关,所以不能根据沸点:H2O>NH3,来比较O与N的非金属性,故b错误;
c.化合物中非金属性强的元素吸引电子能力强先负价,已知NO中N为+2价,O为-2价,所以非金属性O大于N,故c正确;
d.不能根据氢化物的碱性判断元素的非金属性,故d错误;
故答案为:2s22p3;ac;
(2)反应中Fe元素的化合价升高,则N元素的化合价降低,所以NaNO2作氧化剂,发生还原反应;维生素C可解毒,说明维生素C能把铁离子还原为亚铁离子,维生素C作还原剂,具有还原性;
故答案为:还原;还原;
(3)氯水加到NaNO2溶液中,二者发生氧化还原反应生成NaNO3和HCl,反应的化学方程式为:NaNO2+Cl2+H2O=NaNO3+2HCl,反应中1molNaNO2失去2mol电子生成1mol;若生成0.1mol NaNO3,则转移0.2mol电子,即0.2NA;
故答案为:NaNO2+Cl2+H2O=NaNO3+2HCl;0.2NA;
(4)HNO2的电离常数大于H2CO3,则HNO2的酸性强,HNO2溶液与Na2CO3溶液等体积混合生成NaNO2和NaHCO3,二者均能水解显碱性,但是HCO3-的水解程度大,HCO3-还能发生很少量的电离,则溶液中阴离子浓度关系为c(NO2-)>c(HCO3-)>c(OH-)>c(CO32-);
故答案为:c(NO2-)>c(HCO3-)>c(OH-)>c(CO32-).
点评 本题考查了电子排布式、元素非金属性强弱的判断、氧化还原反应、离子浓度大小比较等,题目难度中等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,注意把握电离常数与酸性强弱的关系.


科目:高中化学 来源: 题型:解答题
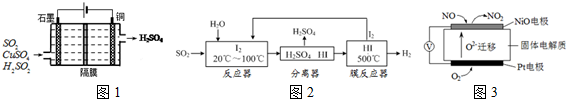
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,乙为
,乙为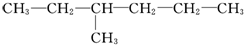 .下列有关它们命名的说法正确的是( )
.下列有关它们命名的说法正确的是( )| A. | 甲、乙的主链碳原子数都是6个 | B. | 甲、乙的主链碳原子数都是5个 | ||
| C. | 甲的名称为2-丙基-1-丁烯 | D. | 乙的名称为3-甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和盐酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 小苏打溶液与少量澄清石灰水混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | Na2CO3溶液中通入少量CO2:CO32-+CO2+H2O═2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{10}$O | |
| B. | 氧离子(O2-)的结构示意图: | |
| C. | 某氧单质的球棍模型: | |
| D. | 某碳氧化合物电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
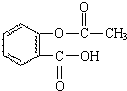 化学和环境保护、食品营养、材料应用等密切相关.
化学和环境保护、食品营养、材料应用等密切相关. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用小苏打治疗胃酸过多:CO3-+2H+═CO2↑+H2O | |
| B. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 硫酸铜溶液中加入过量铁粉:Cu2++2Fe═2Fe3++Cu | |
| D. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-═2AlO${\;}_{2}^{-}$+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com