
 已知A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期元素且最外层只有2对成对电子,F元素与Cr元素位于同一周期的副族元素中且基态原子的最外层电子数与Cr原子相同.
已知A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期元素且最外层只有2对成对电子,F元素与Cr元素位于同一周期的副族元素中且基态原子的最外层电子数与Cr原子相同. .
.分析 A的周期数等于其主族序数,应为H元素,B原子的价电子排布为nsnnpn,n=2,应为C元素,D是地壳中含量最多的元素,应为O元素,则C为N元素,E是第四周期的p区元素且最外层只有2对成对电子,应为Se元素,F元素与Cr元素位于同一周期的副族元素中且基态原子的最外层电子数与Cr原子相同,电子排布式为1s22s22p63s23p63d104s1,应为Cu元素,以此解答该题.
(1)同周期元素从左到由元素的第一电离能呈增大趋势,N原子2p亚层属于半充满的稳定结构,难失去一个电子,第一电离能大于O元素;
(2)CO32-中心原子形成3个σ键,孤电子对数为$\frac{6-2×3}{2}$=0,杂化轨道数目为3,NH4+的空间构型为正四面体;
(3)Se的外围电子排布为4s24p4,结合泡利原理、洪特规则画出价电子排布图;
(4)CN-与N2为等电子体,含有C≡N键,三键含有1个σ键、2个π键;
(5)同一主族元素,其氢化物的沸点随着原子序数的增大而呈增大趋势,但含有氢键的氢化物沸点更高.
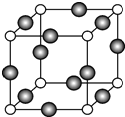
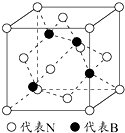
(6)由晶胞结构可知,N原子位于顶点,Cu位于棱上,利用均摊法计算晶胞中N、Cu原子数目,进而确定化学式;晶胞中位于顶点和棱心的位置最近,则N原子的配位数是6,若相邻C原子和F原子间的距离为a nm,则边长为2a nm,表示出晶胞质量,根据ρ=$\frac{m}{V}$计算.
解答 解:AA的周期数等于其主族序数,应为H元素,B原子的价电子排布为nsnnpn,n=2,应为C元素,D是地壳中含量最多的元素,应为O元素,则C为N元素,E是第四周期的p区元素且最外层只有2对成对电子,应为Se元素,F元素与Cr元素位于同一周期的副族元素中且基态原子的最外层电子数与Cr原子相同,电子排布式为1s22s22p63s23p63d104s1,应为Cu元素;
(1)同周期元素从左到由元素的第一电离能呈增大趋势,由于O原子核外价电子排布式2s22p4,而N原子核外价电子排布式2s22p3,2p亚层属于半充满的稳定结构,难失去一个电子,因此第一电离能较大的为N元素,则顺序为:N>O>C;
故答案为:N>O>C;
(2)CO32-中心原子形成3个σ键,孤电子对数为$\frac{6-2×3}{2}$=0,杂化轨道数目为3,杂化轨道的类型为sp2,NH4+中心原子形成4个σ键,空间构型为正四面体,
故答案为:sp2;正四面体;
(3)Se的外围电子排布为4s24p4,价电子排布图为 ;
;
故答案为: ;
;
(4)CN-与N2为等电子体,含有C≡N键,则1mol BC-中含有π键的数目为2NA;
故答案为:2NA;
(5)同一主族元素,其氢化物的沸点随着原子序数的增大而呈增大趋势,但含有氢键的氢化物沸点更高,水中含有氢键、H2S中不含氢键,所以沸点:H2O>H2S,
故答案为:H2O>H2S;
(6)由晶胞结构可知,N原子位于顶点,晶胞中N个数为8×$\frac{1}{8}$=1,Cu位于棱上,晶胞中Cu原子个数为12×$\frac{1}{4}$=3,则化学式为Cu3N,晶胞中位于顶点和棱心的位置最近,则N原子的配位数是6;
若相邻C原子和F原子间的距离为acm,则边长为2acm,晶胞的体积为8a3cm3,晶胞的质量为$\frac{206}{{N}_{A}}$g,则密度为$\frac{206}{{N}_{A}}$g÷8a3cm3=$\frac{\frac{206}{{N}_{A}}}{8a{\;}^{3}}$g/cm3;
故答案为:Cu3N;6;$\frac{\frac{206}{{N}_{A}}}{8a{\;}^{3}}$.
点评 本题考查物质的结构与性质,涉及核外电子排布、电离能、杂化方式、空间构型、化学键、元素周期律应用、晶胞计算等,难度中等,注意掌握利用均摊法进行晶胞的有关计算.


科目:高中化学 来源: 题型:选择题
| A. | VL该气体的质量(以g为单位) | B. | 1L该气体中所含的分子数 | ||
| C. | 1mol该气体的体积(以L为单位) | D. | 1L该气体的质量(以g为单位) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大反应体系的压强,反应速率一定增大 | |
| C. | 该反应是放热反应,降低温度正反应速率加快 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼和氮元素在化学中有很重要的地位,回答下列问题:
硼和氮元素在化学中有很重要的地位,回答下列问题: .预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.
.预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 利用所学化学知识解答问题:
利用所学化学知识解答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
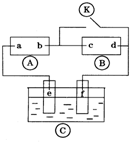 图
图 为直流电源,
为直流电源,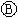 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,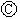 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现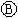 上的c点显红色,为实现铁上镀锌,接通
上的c点显红色,为实现铁上镀锌,接通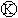 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A. | a为直流电源的负极 | B. | f电极为锌板 | ||
| C. | e极发生还原反应 | D. | c极发生的反应为2 H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16g14CH4所含中子数目为8NA | |
| B. | 标准状况下,7.8g苯中含碳碳双键的数目为0.3NA | |
| C. | 含0.2NA个阴离子的Na2O2和水完全反应转移0.2mol电子 | |
| D. | 5.6g铁粉在足量的氯气中充分燃烧,得到电子数为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com