
【题目】图为元素在生物体内的含量分布情况,下列表述错误的是
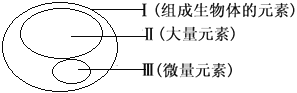
A. P、S、K、Ca、Zn属于大量元素
B. 在非生物界中都能找到,体现生物界与非生物界的统一性
C. Ⅱ和Ⅲ为生物体的必需元素,一旦缺乏就可能会导致相应的病症
D. Ⅲ含量虽少,却是生物体正常生命活动不可缺少的
【答案】A
【解析】
①组成生物体的化学元素根据其含量不同分为大量元素和微量元素,前者包括C、H、O、N、P、S、K、Ca、Mg等,后者包括Fe、Mn、Zn、Cu、B、Mo等,都是生命活动不可缺少的。②组成细胞的各种化学元素,在无机自然界中都能找到,没有一种化学元素是细胞所特有的,这体现了生物界与非生物界具有统一性,但是每种元素在细胞内和无机自然界里的含量相差很大,说明生物界与非生物界存在差异性。
P、S、K、Ca属于大量元素,Zn 属于微量元素,A错误;组成生物体的各种化学元素,在非生物界中都能找到,没有一种是生物界特有的,体现生物界与非生物界的统一性,B正确;大量元素和微量元素均为必需元素,一旦缺乏可能会导致相应的病症,C正确;微量元素含量虽少,但却是生物体正常生命活动不可缺少的,D正确。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】聚合物( )是良好的生物可降解材料,其合成路线如下:
)是良好的生物可降解材料,其合成路线如下:

已知: (R,R’,R’’代表烷基或H)
(R,R’,R’’代表烷基或H)
(1)已知A的核磁共振氢谱有二个峰,A的结构简式是_______。
(2)B可使澄清的苯酚钠水溶液变浑浊,B中的含氧官能团名称是________。
(3)B与试剂a在一定条件下反应生成C的化学方程式是________。
(4)D转化为E的化学方程式是________。
(5)F的结构简式是________。
(6)由G生成H的化学方程式是________。
(7)聚合物P具有较好的可降解性,其原因是_________。
(8)以1,3-丁二烯为原料(无机试剂任选),设计J的合成路线________。合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”"
(1)Ti位于周期表的___________(填“s”“p”“d"或“ds")区,写出基态Ti的外围电子排布式:___________。
(2)月球岩石——玄武岩的主要成分为钛酸亚铁( FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。其中SO42-的 VSEPR模型为___________。
(3)TiCl2可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛作催化剂时,可以发生下列聚合反应:nCH3CH=CH2 ![]() ,该反应中涉及的物质中碳原子的杂化轨道类型有___________:反应中涉及的元素中电负性最大的是___________。
,该反应中涉及的物质中碳原子的杂化轨道类型有___________:反应中涉及的元素中电负性最大的是___________。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1mol Fe(CO)5分子中含___________molσ键,与CO互为等电子体的离子是___________(填化学式,写一种)。
(5)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,该六棱柱底边边长为c cm,高为a cm,则:

①该晶胞中Ti的配位数为___________。
②该钛晶体的密度为______________________g·cm-3(用NA表示阿伏加德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三种溶液,进行如下操作
![]()
则甲、乙、丙三种溶液中溶质可能是
A.BaCl2、H2SO4、MgCl2 B.CaCl2、HNO3、AgNO3
C.CaCl2、HNO3、NaCl D.BaCl2、HCl、NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国早期科技丛书《物理小识·金石类》写到:“青矾厂气熏人,衣服当之易烂,载木不盛,惟乌柏树不畏其气”,“青矾”则是绿矾,强热时发生如下反应:
2FeSO4·7H2O→Fe2O3+SO3+SO2+7H2O
回答下列问题:
(1)基态硫原子的价层电子排布式___________,其最高能级上电子云形状是___________,上述四种元素电负性由大到小的顺序是___________,从结构的角度解释Fe3+稳定性强于Fe2+的原因是__________。
(2)氧、硫能形成许多化合物,如:H2O、SO2、SO3、SO42-,这些物质的中心原子杂化轨道类型为SP2的是___________,空间构型是V形的分子是___________,属于非极性分子的是___________。
(3)已知Fe2O3熔点为1565℃,在熔化状态下液体中存在两种粒子,则其晶体类型最可能是___________,若FeO与Fe2O3晶体类型相同,则二者熔点较高的物质是___________。
(4)铁的某种氧化物晶胞如图所示(实心球为铁原子);
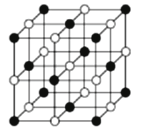
①该氧化物的化学式为___________。
②氧、铁的原子半径分别为rO pm、rFe pm,晶体密度为ρg·cm-3,阿伏伽德罗常数的值为NA,该晶胞的空间利用率为___________(用含π的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法不正确的是
A. 标准状况下3.6 g H2O含有的电子数为2NA
B. 2.8 g乙烯与聚乙烯的混合物含有的极性键为0.4NA
C. 0.l moI Cl2与足量的铁粉充分反应转移的电子数为0.2NA
D. 1 L 0.2 mol/l的K2Cr2O7溶液中![]() 的数目为0.2NA
的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A. 含有NA个氧原子的氧气在标准状况下的体积约为22.4 L
B. 2 L 0.3 mol·L-1的硫酸钾溶液中钾离子浓度为0.6 mol·L-1
C. 常温常压下,32 g O2和O3的混合气体所含原子数为2NA
D. 25 ℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pCu=-1gc(Cu+),pX=-lgc(X-)。298K时,Ksp(CuCl)=a×10-6,Ksp(CuBr)=b×10-9,Ksp(CuI)=c×10-12。在CuCl、CuBr、CuI的饱和溶液中阳离子和阴离子浓度关系如图所示。下列说法正确的是

A. 298K时,在CuCl的饱和溶液中加入少量NaCl,c(Cu+)和c(Cl-)都减小
B. 图中x代表CuI曲线,且P点c(Cu+)=c(I-)
C. 298K时增大M点的阴离子浓度,则y上的点向N点移动
D. 298K时CuBr(s)+I-(aq) ![]() CuI(s)+Br-(aq)的平衡常数K的数量级为103或102
CuI(s)+Br-(aq)的平衡常数K的数量级为103或102
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com