
【题目】Ⅰ、某校兴趣小组的同学进行“比较过氧化氢在不同条件下的分解”的实验,他们对实验的处理如下表所示:
试管 组别 | 实验处理 | ||
加入体积分数为3%的H2O2溶液(mL) | 温度 | 加入试剂 | |
试管1 | 2 | 常温 | 2滴蒸馏水 |
试管2 | a | 90℃ | 2滴蒸馏水 |
试管3 | 2 | 常温 | 2滴质量分数为3.5%的FeCl3溶液 |
试管4 | 2 | b | 2滴质量分数为20%的肝脏研磨液 |
(1)表格中的a、b应填写的内容分别是 和 。在上表的实验处理中,研究了哪些自变量? 。
(2)表中的哪两组试管对照,可研究生物催化剂与无机催化剂催化效率的差别? 。
(3)在探究温度对酶活性的影响时, (填“能”或“不能”)用过氧化氢为实验材料。
Ⅱ、某校兴趣小组的同学进行了“探究酵母菌细胞呼吸的方式”的实验。请据题分析作答:
现提供若干套(每套均有数个)实验装置如图Ⅰ(a~d)所示:

(1)若要探究的具体问题是:酵母菌是否在有氧、无氧条件下均能产生CO2。根据实验目的选择装置序号,有氧条件下的装置序号为c→b→a→b,则无氧条件下的装置序号为: (用字母和箭头表示)。
(2)装置中c瓶的作用是: ,b瓶中澄清的石灰水还可用溴麝香草酚蓝水溶液代替,则颜色变化为: 。
(3)利用图Ⅱ所示装置(橡皮塞上的弯管为带有红色液滴的刻度玻璃管),探究酵母菌的细胞呼吸类型。想得到实验结论还必须同时设置对照实验,对照实验装置(假设该装置编号为Ⅲ)除用等量清水代替NaOH溶液外,其他设计与装置Ⅱ相同。
请预测与结论相符合的现象,并填写下表:
序号 | 装置中红色液滴的移动现象 | 结论 | |
装置Ⅱ | 装置Ⅲ | ||
1 | 向左移 | 不移动 | 只进行有氧呼吸 |
2 | 不移动 | 向右移 |
|
3 | 向左移 |
| 既进行有氧呼吸,又进行无氧呼吸 |
【答案】Ⅰ、(1)2 常温 温度和催化剂(答对一个0.5分,答错不给分)
(2)试管3和试管4(写3、4不扣分,序号格式写错不给分)
(3)不能
Ⅱ、(1)d→b
(2)吸收空气中CO2,排除其对实验结果的干扰(其他合理答案亦可酌情给分) 由蓝变绿再变黄
(3)只进行无氧呼吸 向右移
【解析】
试题分析:Ⅰ、(1)分析表格中4组实验可知,本实验的自变量是温度和催化剂种类,因变量是气泡的数量,各组加入H2O2的量和温度都是无关变量,应保证相同且适宜,所以表格中的a应填写2,b处应填写常温。
(2)表格中试管3和试管4的自变量是催化剂的种类,其余无关变量相同,符合单一变量的对照原则,可以用来研究生物催化剂与无机催化剂催化效率的差别。
(3)过氧化氢受热会分解,如果用其做温度探究的实验,会对实验结果带来干扰,因此在探究温度对酶活性的影响时,不能用过氧化氢为实验材料。
Ⅱ、(1)无氧条件应密封,所以无氧条件下的装置序号为d→b。
(2)装置中c瓶内装入的是NaOH溶液, NaOH溶液可以将空气中的CO2吸收,排除其对实验结果检测过程的干扰;b瓶中澄清的石灰水是用来检测CO2的指示剂,还可用其他的检测CO2的指示剂即溴麝香草酚兰水溶液来代替,CO2可使溴麝香草酚兰水溶液由蓝变绿再变黄。
(3)根据题意可知,装置Ⅱ内的NaOH溶液可将酵母菌呼吸作用产生的CO2吸收,所以装置Ⅱ内红色液滴移动的距离可代表酵母菌有氧呼吸消耗的O2量;装置Ⅲ内用等量清水代替NaOH溶液,所以装置Ⅲ内红色液滴移动的距离可代表酵母菌呼吸作用中CO2产生量与O2消耗量的差值。根据表格可知,第2组实验中装置Ⅱ内红色液滴不移动,说明酵母菌没有消耗O2,装置Ⅲ内红色液滴向右移,说明酵母菌呼吸作用产生了CO2,综合分析可知此时酵母菌只进行无氧呼吸;等3组实验中酵母菌既进行有氧呼吸又进行无氧呼吸时,酵母菌吸收O2的体积小于释放CO2的体积,所以装置Ⅲ内压强增大,红色液滴向右移,而装置Ⅱ内红色液滴向左移。


科目:高中化学 来源: 题型:
【题目】氢叠氮酸(HN3)和莫尔盐(NH4)2SO4·FeSO4·6H2O是两种常用原料。
(1)氨叠氮酸易溶于水,25℃时,该酸的电离常数为Ka=10×10-5
①氢叠氮酸在水溶液中的电离方程式为________________________________
②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,混合溶液中各离子和HN3分子浓度由大到小的顺序为__________________________。
③已知T℃时,Ksp(CuN3)=5.0×10-9,Ksp(Cu2S)=2.5×10-48,则相同温度下,2CuN3(s)+S2-(aq)![]() Cu2S(s)+2N3-(aq)该反应正反应方向_________(“能”或“不能”)进行基本彻底,请通过计算说明_________________________。
Cu2S(s)+2N3-(aq)该反应正反应方向_________(“能”或“不能”)进行基本彻底,请通过计算说明_________________________。
(2)在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体,为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 25.52 | 25.02 | 24.98 |
滴定终点的现象是________________,通过实验数据,计算该产品的纯度为_________(用含字母a、c的式子表示)。上表第一次实验中记录数据明显大于后两次,其原因可能是_________。
A.第一次滴定时,锥形瓶用待装液润洗
B.该酸性高锰酸钾标准液保存时间过长,部分变质
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )

A. O2在电极b上发生还原反应
B. 溶液中OH-向电极a移动
C. 反应消耗的NH3与O2的物质的量之比为4∶5
D. 负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
(1)如图为某实验小组依据氧化还原反应设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过________mol电子。

(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极会产生气泡,这是由于NH4Cl溶液显________(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因________________________________________________________________,用吸管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:“溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO![]() ,试写出该反应(红色褪去)的离子方程式:__________________________________________。
,试写出该反应(红色褪去)的离子方程式:__________________________________________。
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示。一段时间后,在甲装置铜丝电极反应为___________;乙装置中石墨(1)电极现象为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为几种化合物的元素组成示意图,以下说法错误的是

A. 若①为某种具有催化作用的化合物,则其水解产物为氨基酸
B. 若②为脂肪,则其大量积累于皮下和内脏器官周围
C. 若③为蓝藻的遗传物质,则其和蛋白质组成染色体
D. 若④为糖原,则其主要分布在人和动物的肌肉和肝脏中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有600 mL某种混合物溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现将此溶液分成三等份,进行如下实验:
(1)向第一份中加入AgNO3溶液,有沉淀产生;
(2)向第二份中加足量NaOH溶液并加热后,收集到气体0.04 mol;
(3)向第三份中加足量BaCl2溶液后,得干燥的沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。 根据上述实验现象,以下推测正确的是
A. K+不一定存在 B. Ba2+、Mg2+不一定都存在
C. Cl-不一定存在 D. 混合溶液中CO32-的浓度为0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)有以下四种物质①22g二氧化碳;②5g氢气;③1.204×1024个氮气分子;④4℃时18g水,质量最大的是_______;常温时体积最大的是________(填序号)。
(2)标准状况下,336L的NH3溶于1L水中,若该溶液的密度为ag/cm3,则其物质的量浓度为____________。
(3)若20g密度为ρg·cm-3的硝酸钙溶液里含1gCa2+,则NO3-的物质的量浓度是_______________。
(4)现有下列九种物质:①AgCl ② 铜 ③液态醋酸 ④CO2 ⑤纯硫酸 ⑥Ba(OH)2固体 ⑦C2H5OH ⑧稀硝酸 ⑨熔融NaOH。
①上述属于电解质的是_______________________。
②上述九种物质中有两种物质之间可发生离子反应H++OH-=H2O,该离子反应对应的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝–空气燃料电池具有原料易得、能量密度高等优点,装置如图所示,电池的电解质溶液为KOH溶液。下列说法不正确的是( )

A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 充电时,电解质溶液中c(OH-)逐渐减小
C. 放电过程的负极反应式:Al+4OH--3e–=[Al(OH)4]-
D. 放电时,有4mol OH-通过阴离子交换膜,消耗氧气22.4L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL某物质的量浓度的AlCl3溶液中逐滴滴加2mol/L NaOH溶液直至过量。经测定,加入的NaOH溶液的体积(mL)和所得沉淀的物质的量(mol)的关系如下图所示。则:
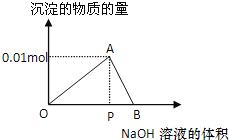
(1)写出代表各线段发生反应的离子方程式:OA段____________,AB段___________,图中线段OP∶PB=___________。
(2)计算原AlCl3溶液的物质的量浓度为_________。
(3)图中A对应的横坐标为______mL。
(4)当加入12mL NaOH溶液时,产生沉淀量为______mol。
(5)当加入的NaOH溶液过量时,使最初生成的沉淀部分溶解,要得到与(4)中相同的沉淀量,加入NaOH溶液的体积为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com