
 水杨酸甲酯又叫冬青油,是一种重要的有机合成原料.某化学小组用水杨酸(
水杨酸甲酯又叫冬青油,是一种重要的有机合成原料.某化学小组用水杨酸( )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
分析 (1)根据题中仪器A的构造判断该仪器的名称;控制温度在85~95℃下恒温下加热反应,需要温度计控制水浴温度加热;
(2)根据甲醇和水杨酸甲酯是互溶的液体,存在沸点差异选择分离方法,也可根据二者在水里的溶解性来选择分离方式;
(3)在洗涤操作中,第一次洗涤的主要目的是除去大部分催化剂硫酸;第二次水洗,主要目的是除去产品中残留的碳酸氢钠;
(4)根据酸能使紫色石蕊试液变红来解答;
(5)先根据水杨酸和甲醇的物质的量,然后判断过量情况,根据不足量计算出理论上生成水杨酸甲酯的物质的量,最后根据实际上制取的水杨酸甲酯计算出产率.
解答 解:(1)由装置中仪器A的构造可知,仪器A的名称是球形冷凝管,使挥发出来的气体冷凝回流;控制温度在85~95℃下恒温下加热反应,温度低于100℃,应采取水浴加热,故答案为:球形冷凝管;水浴加热;
(2)甲醇和水杨酸甲酯是互溶的液体,可用蒸馏来分离;甲醇易溶于水,水杨酸甲酯不溶于水,可以水洗来分离,故答案为:蒸馏(或水洗分液);
(3)反应后的溶液要经过多次洗涤,在洗涤操作中,第一次水洗的主要目的是除去大部分催化剂硫酸,5%NaHCO3溶液既可以除去未洗净的硫酸,也可以降低酯的溶解度,但第二步洗涤后生成的酯中混有NaHCO3,所以第二次水洗,主要目的是除去产品中残留的碳酸氢钠,故答案为:洗掉大部分硫酸;洗掉碳酸氢钠;
(4)水杨酸呈酸性,所以向产品中滴加少量的紫色石蕊试液,观察是否变红即可,故答案为:向产品中滴加少量的紫色石蕊试液,观察是否变红;
(5)水杨酸和甲醇的物质的量分别为:0.05mol,0.75mol,由于水杨酸和甲醇是按照1:1进行反应,所以甲醇过量,生成水杨酸甲酯的量要按照水杨酸的物质的量计算,即理论上生成0.05mol水杨酸甲酯;实际上生成的水杨酸甲酯的质量为4.5g,物质的量为:$\frac{4.5g}{152g/mol}$=0.0296mol,所以实验中水杨酸甲酯的产率为$\frac{0.0296mol}{0.05mol}$×100%=59%,故答案为:59%.
点评 以物质的制备为背景,考查了常见仪器的构造与安装、混合物的分离、提纯、物质的制取、物质产率的计算等知识,涉及的知识面较大,题目难度较大,对提高学生的分析、理解及灵活应用所学知识的能力有利.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
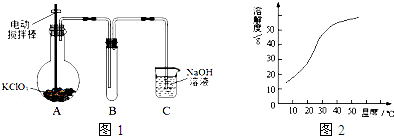
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它是F-离子.1mo1B单质能从盐酸中置换出3g氢气,此时B转变为与Ne原子具有相同电子层结构的离子,则B元素是Al;B的最高价氧化物的对应水化物的化学式为Al(OH)3.C元素有3个电子层,且最外电子层比L电子层少2个电子,则C元素是SC与Na反应后生成物的电子式为
,它是F-离子.1mo1B单质能从盐酸中置换出3g氢气,此时B转变为与Ne原子具有相同电子层结构的离子,则B元素是Al;B的最高价氧化物的对应水化物的化学式为Al(OH)3.C元素有3个电子层,且最外电子层比L电子层少2个电子,则C元素是SC与Na反应后生成物的电子式为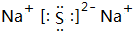 ,化合物中的化学键属于离子键.
,化合物中的化学键属于离子键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+ SCN-Na+ NO${\;}_{3}^{-}$ | B. | Cu2+ SO${\;}_{4}^{2-}$HCO${\;}_{3}^{-}$K+ | ||
| C. | CO${\;}_{3}^{2-}$Na+Cl-K+ | D. | Ba2+ Ca2+ Cl-NO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,化合物BA2的结构式是:S=C=S;
,化合物BA2的结构式是:S=C=S; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com