
反应4A(s)+3B(g) 2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1。对此反应速率的表示正确的 是( )
A.在2 min内的反应速率,用C表示是0.3 mol·L-1·min-1
B.用A表示的反应速率是0.4 mol·L-1·min-1
C.在2 min末的反应速率,用B表示是0.3 mol·L-1·min-1
D.分别用B、C、D表示反应速率,其比值是3∶2∶1
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
把2.0 mol CuSO4和1.0 mol
CuSO4和1.0 mol H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:
H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:
(1)混合溶液中CuSO4和H2SO4的物质的量浓度
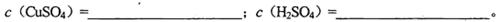
(2)混合液中和的物质的量浓度

(3)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余。此时溶液中的物质的量浓
度。c(Fe2+)=_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、X是中学化学常见物质,均由短
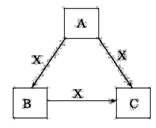 周期元素组成,转化关系如图。
周期元素组成,转化关系如图。
请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该元素
在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素在元素周期表中的位置为__________,向水中加入X物质,X对水的电离平衡的影响是 (填“促进”、“抑制”或 “无影响”) 。
②A与C的水溶液混合后生成B反应的离子方程式为 。
(2)若A为固态非金属单质,A与X同周期,同时A在X中燃烧,产生白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
①若A为该元素的白色固体单质,则1mol A单质中含共价键数目为 NA ,B的电子式为___________。
②X与水反应的离子方程式为 。
(3)若A、B、C的焰色反应呈黄色,水溶液均为碱性,常温下,X为气态酸性氧化物。
①A中所含有的化学键类型是_____________________。
②C溶液中离子浓度由小到大的顺序是__ _________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在无色透明的强酸性溶液中,能大量共存的离子组是( )
A. Na+、NO3-、Mg2+、Cl- B. Na+、CO32-、K+、NO3-
C. Cu2+、K+、SO42-、Cl- D. Ba2+、K+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
某中性的溶液中含有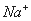 、
、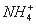 、
、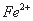 、
、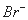 、
、 、
、 、
、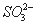 七种离子中的某几种。进行以下实验:①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;②向呈橙黄色溶液中加入
七种离子中的某几种。进行以下实验:①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;②向呈橙黄色溶液中加入 溶液时无沉淀生成;③橙黄色溶液不能使淀粉变蓝。由此可以推知该溶液中肯定存在的离子是 ( )
溶液时无沉淀生成;③橙黄色溶液不能使淀粉变蓝。由此可以推知该溶液中肯定存在的离子是 ( )
A.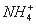 、
、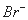 、
、 B.
B.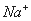 、
、 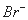 、
、
C.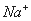 、
、 、
、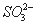 D.
D.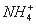 、
、 、
、
查看答案和解析>>
科目:高中化学 来源: 题型:
第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗。
(1)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池工作原理示意如下图,其总反应式为:H2+2NiOOH  2Ni(OH)2
2Ni(OH)2
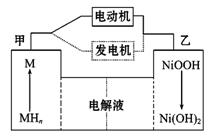
注:图中MHn表示H2附着在M上
根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH (填“增大”、“减小”或“不变”),该电极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据反应①2FeCl3+2KI===2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是
A.Fe3+>Cl2>I2 B.Cl2>I2>Fe3+ C.I2>Cl2>Fe3+ D.Cl2>Fe3+>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法。
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理 。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是 (填序号)
a.Ba(NO3)2 b.BaCl2 c.Ba(OH)2 d.溶有NH3的BaCl2溶液
③若将足量SO2气体通入0.2 mol·L-1的NaOH溶液,所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为 。
(2)采用电解法处理含有Cr2O72-的酸性废水,在废水中加入适量NaCl,用铁电极电解一段时间后,有Cr(OH)3和Fe(OH)3沉淀生成,从而降低废水中铬元素的含量。若阳极用石墨电极则不能产生Cr(OH)3沉淀,用必要的化学语言说明原因___________________。
 (3)废氨水可以转化成氨,氨再设计成碱性燃料电池。右图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作 极(填“正”“负”“阴”或“阳”),其电极反应式为 ;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为 ,请判断T 25℃(填“>”“<”“=”)。
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。右图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作 极(填“正”“负”“阴”或“阳”),其电极反应式为 ;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为 ,请判断T 25℃(填“>”“<”“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com