
CH4(g)+2NO2(g)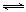 N2(g)+CO2(g)+2H2O(g)
ΔH=−867
kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g)
ΔH=−867
kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
|
实验编号 |
温度 |
时间 |
0 |
10 |
20 |
40 |
50 |
|
1 |
130℃ |
n(CH4)/mol |
0.50 |
0.35 |
0.25 |
0.10 |
0.10 |
|
2 |
180℃ |
n(CH4)/mol |
0.50 |
0.30 |
0.18 |
|
0.15 |
(1)开展实验1和实验2的目的是 。
(2)180℃时,反应到40min,体系 (填“是”或“否”)达到平衡状态,理由是 ;CH4的平衡转化率为 。
(3)已知130℃时该反应的化学平衡常数为6.4,试计算a的值。(写出计算过程)
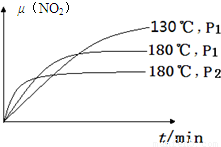
(4)一定条件下,反应时间t与转化率μ(NO2)的关系如图所示,请在图像中画出180℃时,压强为P2(设压强P2>P1)的变化曲线,并做必要的标注。

(5)根据已知求算:ΔH2= 。
CH4(g)+4NO2(g)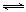 4NO(g)+CO2(g)+2H2O(g) ΔH1=−574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=−574 kJ·mol-1
CH4(g)+4NO(g)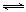 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2
(16分)有效数字错误或无单位运算或无作答,总扣1分
(1)研究温度对该化学平衡的影响(2分)
(2)是(1分) 温度升高,反应加快,对比实验1,高温下比低温下更快达到平衡状态。可确定40min时反应已经达平衡状态(2分) 70%(2分)
(3)
CH4(g)+2NO2(g)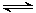 N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g)
起始浓度(mol/L): 0.5 n 0 0 0
变化浓度(mol/L): 0.40 0.80 0.40 0.40 0.80
平衡浓度(mol/L): 0.10 n-0.80 0.40 0.40 0.80 (2分)
则: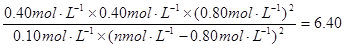 ,解得a=1.2
,解得a=1.2
答:a的值为1.2 (2分)
(4)
(2分,无标注扣1分)
(5)−1160kJ/mol(3分)
【解析】
试题分析:(1)控制变量进行探究才能尽快得出合理结论,依题意可知,实验1和2的研究目的是温度对化学平衡的影响,其他条件保持不变,仅仅反应温度分别为130℃、180℃;(2)130℃时,反应到40min时甲烷的物质的量保持不变,说明已达平衡,升高温度,反应速率增大,达到平衡的时间缩短,则180℃时,反应到40min,体系一定达到平衡状态;由于平衡时甲烷的物的量保持不变,读表可知平衡时甲烷为0.15mol,由于起始时甲烷为0.50mol,则甲烷的平衡转化率=(0.50—0.15)mol/0.50mol×100%=70%;(3)根据表中数据,130℃时:
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g)
起始浓度(mol/L) 0.5 n 0 0 0
变化浓度(mol/L) 0.4 0.8 0.4 0.4 0.8
平衡浓度(mol/L) 0.1 n—0.8 0.4 0.4 0.8
则130℃时该反应的K=[c(N2)×c(CO2)×c2(H2O)]/[c(CH4)×c2(NO2)]=(0.4×0.4×0.82)/[0.1×(n—0.8)2]=6.4, 解得:n=1.2;
(4)180℃、P1变为180℃、P2,就是增大压强,则反应速率增大,平衡左移,二氧化氮的平衡转化率减小,因为正反应是气体体积增大的反应;画图要点为:①起点与180℃、P1时相同;②未达平衡前,180℃、P2时曲线位于180℃、P1时曲线的左边;③180℃、P2时达到平衡的时间小于180℃、P1时;④平衡时,180℃、P2时曲线位于180℃、P1时曲线的下边;
(5)CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)
ΔH=−867
kJ·mol-1,由于系数加倍焓变也加倍,则2CH4(g)+4NO2(g)
N2(g)+CO2(g)+2H2O(g)
ΔH=−867
kJ·mol-1,由于系数加倍焓变也加倍,则2CH4(g)+4NO2(g)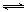 2N2(g)+2CO2(g)+4H2O(g)
ΔH=−2×867 kJ·mol-1,由于CH4(g)+4NO2(g)
2N2(g)+2CO2(g)+4H2O(g)
ΔH=−2×867 kJ·mol-1,由于CH4(g)+4NO2(g)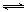 4NO(g)+CO2(g)+2H2O(g) ΔH1=−574 kJ·mol-1,根据盖斯定律,前者减去后者可得CH4(g)+4NO(g)
4NO(g)+CO2(g)+2H2O(g) ΔH1=−574 kJ·mol-1,根据盖斯定律,前者减去后者可得CH4(g)+4NO(g)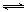 2N2(g)+CO2(g)+2H2O(g),且焓变等于−1160kJ/mol,故ΔH2=−1160kJ/mol。
2N2(g)+CO2(g)+2H2O(g),且焓变等于−1160kJ/mol,故ΔH2=−1160kJ/mol。
考点:考查化学反应原理大题,涉及控制变量实验、温度对化学平衡的影响、平衡转化率的计算、根据平衡常数求反应物的起始量、压强对化学反应速率和化学平衡的影响图像、盖斯定律、热化学方程式等。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:阅读理解
(14分)随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为 。
(2)全钒氧化还原液流电池,是目前发展势头强劲的优秀绿色环保储能电池。
其电池总反应为:
V3++VO2++H2OVO2++2H++V2+。
充电过程中,H+向 迁移(填“阴极区”或“阳极区”)。充电时阴极反应式为 。
(3)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g);△H<0。
该反应的化学平衡常数表达式为K= 。
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如上图所示。若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、 “向右”或“不”)。
20min时,若改变反应条件,导致N2浓度发生如上图所示的变化,则改变的条件
可能是 (填序号)。
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(4)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。
![]() ⑴汽车内燃机工作时引起反应:N2(g)+O2(g)
⑴汽车内燃机工作时引起反应:N2(g)+O2(g)2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则T ℃时该反应的平衡常数
K= ▲ 。(计算结果保留小数点后两位数字)
⑵一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如右图所示。
(已知:T1<T2)
①反应 2NO(g) N2(g)+O2(g)为(填“吸热”或“放热”) ▲ 反应。
②一定温度下,能够说明反应 2NO(g) N2(g)+O2(g) 已达到平衡的是(填序号)▲。
a.容器内的压强不发生变化 b.NO分解的速率和NO生成的速率相等
c.NO、N2、O2的浓度保持不变 d.单位时间内分解4 mol NO,同时生成2 mol N2
⑶①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ·mol-1
△H2= ▲ 。
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为 ▲ 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省邯郸市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
随着大气污染的日趋严重,国家拟于“十二”五期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) =4NO(g) + CO2(g) +2H2O(g)??? ⊿H= -574 kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g)??? ⊿H= -1160 kJ·mol-1
③H2O(g) = H2O(l)???? △H= -44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式?????????? 。
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为????????????????????????????????? 。
??? 浓度/mol·L-1
| NO | N2 | CO2 |
0 | 1.00 | 0 | 0 |
10 | 0.58 | 0.21 | 0.21 |
20 | 0.40 | 0.30 | 0.30 |
30 | 0.40 | 0.30 | 0.30 |
40 | 0.32 | 0.34 | 0.17 |
50 | 0.32 | 0.34 | 0.17 |
(3)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①10min~20min以v(CO2) 表示的平均反应速率为 ?????????????????????? 。
②根据表中数据,计算T1℃时该反应的平衡常数为??? ??? (保留两位小数)。
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率?????? (填“增大”、“不变”或“减小”) 。
④下列各项能作为判断该反应达到平衡的是 (填序号字母)。
A.容器内压强保持不变
B.2v正(NO) = v逆(N2)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
⑤30min末改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是?????????? 。请在图中画出30min至40min 的变化曲线。

查看答案和解析>>
科目:高中化学 来源:2013-2014学年辽宁省五校协作体高三上学期期中考试化学试卷(解析版) 题型:填空题
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol—1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol—1
则甲烷直接将NO2还原为N2的热化学方程为 。
(2)降低汽车尾气的方法之一是在排气管上安装催化 转化器,发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g)
△H<0。
N2(g)+2CO2(g)
△H<0。
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示,该反应的化学平衡常数为K= 。

若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、 “向右”或“不”)。
20min时,若改变反应条件,导致N2浓度发生如上图所示的变化,则改变的条件可能是 (填序号)。
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(3)肼(N2H4)用亚硝酸(HNO2)氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977。写出肼与亚硝酸反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省高三上学期9月月考化学试卷 题型:填空题
近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。
 ⑴汽车内燃机工作时引起反应:N2(g)+O2(g)
⑴汽车内燃机工作时引起反应:N2(g)+O2(g)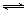 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则T ℃时该反应的平衡常数
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则T ℃时该反应的平衡常数
K= ▲ 。(计算结果保留小数点后两位数字)
⑵一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如右图所示。
(已知:T1<T2)
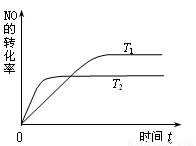
①反应 2NO(g) 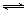 N2(g)+O2(g)为(填“吸热”或“放热”) ▲
反应。
N2(g)+O2(g)为(填“吸热”或“放热”) ▲
反应。
②一定温度下,能够说明反应 2NO(g) 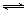 N2(g)+O2(g) 已达到平衡的是(填序号)▲
。
N2(g)+O2(g) 已达到平衡的是(填序号)▲
。
a.容器内的压强不发生变化 b.NO分解的速率和NO生成的速率相等
c.NO、N2、O2的浓度保持不变 d.单位时间内分解4 mol NO,同时生成2 mol N2
⑶①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ·mol-1
△H2= ▲ 。
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com