
【题目】电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是

A. 左侧a极与电源的负极相连
B. 电解使右侧溶液的pH减小
C. 离子交换膜d为阳离子交换膜(允许阳离子通过)
D. 当电路中通过1mol电子时,气体甲在标准状况下的体积为11.2L。
【答案】C
【解析】
由装置图分析可以知道是电解装置,电极硫酸钠溶液,实质是电解水,气体甲与气体乙的体积比约为1:2,气体甲为氧气,气体乙为氢气,阳极生成氧气,电极反应4OH--4e-=2H2O+O2↑,阴极生成氢气,2H++2e-=H2↑,气体体积比为1:2,所以判断a电极是阳极,b电极是阴极,在阳极室得到硫酸,在阴极室得到氢氧化钠,则c为阴离子交换膜,d为阳离子交换膜。据此分析。
A、根据以上分析可以知道a电极为阳极,与电源正极相连,故A错误;
B、右侧阴极生成氢气,电极反应2H++2e-=H2↑,消耗H+,pH增大,故B错误;
C、阳极a生成氧气,电极反应4OH--4e-=2H2O+O2↑,阳极室水的电离平衡被破坏生成氢离子,生成产物丙为硫酸,阴极生成氢气,2H++2e-=H2↑,生成产物丁为氢氧化钠,则c为阴离子交换膜,d为阳离子交换膜,故C正确;
D、气体甲为氧气,阳极生成氧气,电极反应4OH--4e-=2H2O+O2↑,由电极反应式可知,当电路中通过1mol电子时,生成0.25mol氧气,在标准状况下的体积为5.6L,所以D选项是错误的。
所以C选项是正确的。


 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其处理流程图如下:

化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-31 | 10-16 | 10-38 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为_____________________________________________________________。
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___________________________;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到____________,恰好能使Fe3+、Al3+沉淀完全(当c≤10-5 mol·L-1时,认为该离子沉淀完全)。
(3)滤渣B的成分是______________。
(4)碱性锌锰电池中,MnO2参与的电极反应式为__________________________________。
(5)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极反应式为___________________________________。
(6)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.920 0 g该样品,与足量酸性KI溶液充分反应后,配制成100 mL溶液。取其中10.00 mL,恰好与25.00 mL 0.080 0 mol·L-1Na2S2O3溶液反应(I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() )。计算可得该样品纯度为_____________。(保留一位小数)
)。计算可得该样品纯度为_____________。(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是五种银盐的溶度积常数(25°C),下列说法错误的是

A. 用硝酸银溶液测定Cl-含量时,可以用硫化钠做指示剂
B. 将氯化银溶解于水后,向其中加入Na2S固体,则可以生成黑色沉淀
C. 氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序减小
D. 沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡可能会发生移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,互为同系物的是
A. CH3CH=CH2与CH3CH3B. 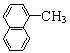 与
与 ![]()
C. CH3CH2OH 与CH2OHCH2OHD. C3H8和C5H12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是药物合成中的一种重要中间体,下面是G的一种合成路线:


回答下列问题:
(1)B的结构简式为__________,其中所含官能团的名称为__________;B生成C的反应类型为__________。
(2)D的名称是__________。
(3)由C和E合成F的化学方程式为________________________________________。
(4)D的同分异构体中,能发生银镜反应且分子结构中含苯环的还有__________种,其中核磁共振氢谱上有6组峰,峰面积之比为1∶1∶1∶1∶1∶1的同分异构体的结构简式为______________________ (一种即可)。
(5)参照上述合成路线,以CH3CH2Cl为原料(其他试剂任选),设计制备巴豆醛(CH3CH=CH
CHO)的合成路线。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。

(1)0.1mol该烃A能与______g溴发生加成反应;加成产物需______mol溴蒸气完全取代;
(2)B中官能团的名称是_________,B通过两次氧化可得到D,也可通过加入的氧化试剂为______任填一种直接氧化为D。
(3)E是常见的高分子材料,写出E的结构简式__________;合成E的反应类型_________;
(4)某同学用如图所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
①实验开始时,试管甲中的导管不伸入液面下的原因是__________________;
②上述实验中饱和碳酸钠溶液的作用是______________________。
③乙醇与乙酸反应的化学方程式是:__________________, 浓硫酸的作用是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g)![]() nY(g),ΔH=QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、容器体积的关系如下表所示,下列说法正确的是
nY(g),ΔH=QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、容器体积的关系如下表所示,下列说法正确的是
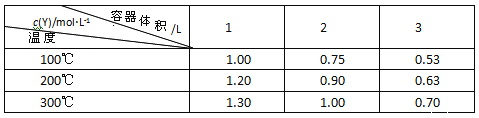
A. m>n B. 温度不变,压强增大,Y的质量分数减少
C. Q<0 D. 体积不变,温度升高,平衡向逆反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com