
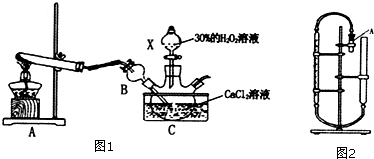
分析 (1)A装置制备氨气,氨气极易溶于水,通入C中溶液中,会发生倒吸,可以判断B装置作用;
(2)温度过高,过氧化氢容易分解;结合C中物质可知,过氧化氢、氨气、氯化钙在溶液中反应生成CaO2•8H2O,同时还生成氯化铵;
(3)CaO2酸化得到H2O2与氯化钙,过氧化氢被酸性高锰酸钾氧化生成氧气,还原得到氯化锰;
(4)加热发生反应:2CaO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+O2↑,根据氧气体积计算样品中CaO2的质量,进而计算CaO2的纯度.
(5)利用生成气体的体积计算样品中CaO2的质量,体积测定要准确,装置气密性要好,气体具有热胀冷缩性质,应恢复室温再测定气体的体积;
(6)由题目信息可知,CaO2与KI在酸性条件下反应生成I2,I元素发生氧化反应,CaO2中氧元素发生还原反应生成水,同时生成KCl、氯化钙.
解答 解:(1)A装置制备氨气,氨气极易溶于水,通入C中溶液中,会发生倒吸,可知B装置作用是:防止倒吸,
故答案为:防止倒吸;
(2)由于温度过高,过氧化氢容易分解,CaO2•8H2O一般在5℃左右的低温下进行,不可太高;结合C中物质可知,过氧化氢、氨气、氯化钙在溶液中反应生成CaO2•8H2O,同时还生成氯化铵,反应方程式为:CaCl2+H2O2+2NH3+8H2O═CaO2•8H2O↓+2NH4Cl,
故答案为:温度过高,过氧化氢容易分解;CaCl2+H2O2+2NH3+8H2O═CaO2•8H2O↓+2NH4Cl;
(3)CaO2酸化得到H2O2与氯化钙,过氧化氢被酸性高锰酸钾氧化生成氧气,还原得到氯化锰,反应离子方程式为:5CaO2+2MnO4-+16H+═2Mn2++5Ca2++5O2↑+8H2O;
故答案为:5CaO2+2MnO4-+16H+═2Mn2++5Ca2++5O2↑+8H2O;
(4)加热发生反应:2CaO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+O2↑,生成氧气为$\frac{1.12L}{22.4L/mol}$=0.05mol,故样品中CaO2的质量为0.05mol×2×72g/mol=7.2g,则CaO2的纯度为$\frac{7.2g}{9.0g}$×100%=80%,
故答案为:80%;
(5)利用生成气体的体积计算样品中CaO2的质量,气体体积测定要准确,实验关键要:检验装置气密性,温度要冷却至室温才可读取气体的体积,
故答案为:检验装置气密性;温度要冷却至室温才可读数;
(6)由题目信息可知,CaO2与KI在酸性条件下反应生成I2,I元素发生氧化反应,CaO2中氧元素发生还原反应生成水,同时生成KCl、氯化钙,反应方程式为:CaO2+2KI+4HCl=I2+CaCl2+2KCl+2H2O,
故答案为:CaO2+2KI+4HCl=I2+CaCl2+2KCl+2H2O.
点评 本题考查实验制备,涉及方程式的书写、物质含量测定、对操作与装置的分析评价,明确实验原理是解答关键,充分考查了学生的分析理解能力、知识迁移运用能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 含0.1NA个 H的H2O中,O的质量为0.8g | |
| B. | 0.012kg C所含的C数为NA | |
| C. | 98g H2SO4溶于2L水,取其中500mL,溶液中c(H+)为1mol/L | |
| D. | 通常状况下,1mol H2O的体积小于22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含元素化合价升高的物质是还原剂 | |
| B. | 氧化剂失去电子,所含元素的化合价升高 | |
| C. | 作氧化剂的物质不能作还原剂 | |
| D. | 化合价降低,失去电子的物质是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K、Na、Al | B. | Na、K、Zn、Fe | C. | Zn、Fe、Cu、Ag | D. | Mg、Al、Zn、Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质每个分子中含有25个原子 | |
| B. | 该物质中碳、氢、钾、氧元素间的质量比是6:7:3:8 | |
| C. | 该物质是由原子直接构成的 | |
| D. | 该物质是由碳、氢、钾、氧四种元素组成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由KAt的水溶液制备砹的化学方程式为2KAt+Cl2═2KCl+At2 | |
| B. | AgAt是一种难溶于水的化合物 | |
| C. | 相同条件下HAt比HI稳定 | |
| D. | At元素位于第六周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子晶体 | 原子晶体 | 分子晶体 | |
| A | NaOH | Ar | SO2 |
| B | H2SO4 | 石墨 | CO2 |
| C | CH3COONa | 石英 | 碘单质 |
| D | Ba(OH)2 | 金刚石 | 氯化铵 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com