
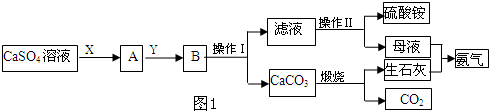
 Ca(OH)2+(NH4)2SO4,向其中加入CO2可以生成CaCO3,平衡向正方向移动,有利于(NH4)2SO4的生成,则X为NH3,Y为CO2;根据反应流程得知:工艺流程中生成NH3和CO2,也需要使用NH3和CO2,可循环利用的物质的有NH3,CO2;
Ca(OH)2+(NH4)2SO4,向其中加入CO2可以生成CaCO3,平衡向正方向移动,有利于(NH4)2SO4的生成,则X为NH3,Y为CO2;根据反应流程得知:工艺流程中生成NH3和CO2,也需要使用NH3和CO2,可循环利用的物质的有NH3,CO2;| m |
| M |
| 16.31g |
| 233g/mol |
| 9.24g |
| 10.0g |
| ||


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
| A、将少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-=SO32-+2HClO |
| B、将2molSO3气体通入一密闭容器中,达平衡后吸收QkJ热量,则该反应的热化学方程式为:2SO3(g)?2SO2(g)+O2(g)△H=+Q kJ/mol |
| C、向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2 |
| D、NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、①②④ |
| C、①④ | D、其它组合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将2mol金属Cu与含2molH2SO4的浓硫酸共热 |
| B、将1 mol MnO2固体与含4molHCl的浓盐酸共热 |
| C、常温下,将32.2g金属钠和5.4g金属铝同时投入到足量水中 |
| D、常温下,将10.8g的Al和22.4g的Fe投入到300g 98%的硫酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学设计了如下方案,来测定过氧化钠的样品的纯度(杂质不参加反应,条件为标准状况).
某同学设计了如下方案,来测定过氧化钠的样品的纯度(杂质不参加反应,条件为标准状况).查看答案和解析>>
科目:高中化学 来源: 题型:

 )
)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com