
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0 kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | Ba(OH)2•8H2O与NH4Cl反应的焓变小于0,所以在常温下能自发进行 |
分析 A、中和热指生成1molH2O时的热效应,H2SO4和Ca(OH)2反应的中和热不变,△H=-57.3 kJ•mol?1;
B、CO(g)的燃烧热是283.0 kJ/mol,含义为:CO(g)+1/2O2(g)=CO2(g),△H=-283.0 kJ/mol,所以则2CO2(g)=2CO(g)+O2(g),△H=+566.0 kJ•mol?1;
C、某些放热反应也需要加热;
D、反应能否自发进行是焓变和熵变共同作用的结果.
解答 解:A、中和热指生成1molH2O时的热效应,H2SO4和Ca(OH)2反应的中和热不变,△H=-57.3 kJ•mol?1,故A错误;
B、CO(g)的燃烧热是283.0 kJ/mol,含义为:CO(g)+1/2O2(g)=CO2(g),△H=-283.0 kJ/mol,所以则2CO2(g)=2CO(g)+O2(g),△H=+566.0 kJ•mol?1,故B正确;
C、某些放热反应也需要加热,如氢气和氧气需要加热反应,故C错误;
D、反应能否自发进行是焓变和熵变共同作用的结果,△H-T△S<0反应自发进行,故D错误;
故选B.
点评 本题考查了燃烧热、中和热概念计算分析,反应自发进行的判断依据,掌握基础注意知识积累是解题关键,题目较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 把少量液溴、白磷放在水下 | |
| B. | 把铝片、镁条放置在不密封的纸盒里 | |
| C. | 把汽油、溴水放在带橡皮塞的玻璃试剂瓶中 | |
| D. | 把硝酸、硝酸银放在配有磨口玻璃塞的棕色瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | 含等物质的量的KHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 少量CO2通入硅酸钠溶液中:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- | |
| D. | 硫化钠水溶液呈碱性:S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去NaHCO3溶液中少量的Na2CO3:通入过量的CO2 | |
| B. | 除去MgCl2溶液中少量的AlCl3:加入过量氢氧化钠溶液,过滤,用蒸馏水洗涤沉淀后用稀盐酸溶解沉淀 | |
| C. | 除去K2CO3固体中少量NaHCO3:置于坩埚中加热 | |
| D. | 用盐酸除去AgCl中少量的Ag2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
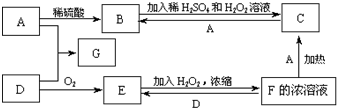 中学化学中几种常见物质的转化关系如图(有部分产物未画出).A是一种金属单质,D是一种非金属固体单质.
中学化学中几种常见物质的转化关系如图(有部分产物未画出).A是一种金属单质,D是一种非金属固体单质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com