
【题目】某小组实验探究葡萄糖、二氧化硫分别与新制氢氧化铜的反应。
实验I新制Cu(OH)2与葡萄糖反应
(1)将1.5mL1.0mol/LCuSO4溶液滴入5mLl.0mol/LNaOH溶液中制得Cu(OH)2悬浊液。相关反应的离子方程式为___________。
(2)在制得的Cu(OH)2悬浊液中加入稍过量葡萄糖溶液,加热煮沸,产生红色沉淀。
①该实验现象说明_______________;
②该原理可用于检测糖尿病患者血液中的______含量。
实验II新制Cu(OH)2与二氧化硫反应
按上述方法重新制取氢氧化铜悬浊液,通入足量二氧化硫,先产生红色沉淀,然后红色沉淀逐渐变为紫红色固体,最终溶液呈无色。
(1)探究红色沉淀转变为紫红色的原因。
将实验I产生的红色沉淀过滤、洗涤,洗涤方法是_____。
将所得固体分成两等份于试管中并加入少量蒸馏水进行对比实验。
实验装置图 |
|
|
操作及现象 | 红色固体很快转变为紫红色固体,溶液呈蓝色。 | 开始红色固体缓慢变为紫红色固体,溶液呈蓝色。试管内紫红色固体逐渐增多,最后溶液变无色。 |
解释及结论 | ①该反应的离子方程式 _________________。 | ②开始时红色固体颜色变化缓慢的原因是_________。 ③所得无色溶液中主要阴离子为___________________。 |
(2)通过上述探究,写出新制氢氧化铜与过量SO2反应的总化学方程式______________。
反思:将表中SO2换为NO2是否能观察到相同现象?回答并解释:__________。
【答案】 Cu2++2OH-=Cu(OH)2↓ Cu(OH)2具有氧化性,葡萄糖具有还原性 葡萄糖 用玻璃棒引流,向过滤器中加入蒸馏水至浸没沉淀,待水流出后,按上述操作重复2~3次 Cu2O+2H+==Cu+Cu2++H2O SO2溶于水后生成的H2SO3酸性比H2SO4弱,c(H+)较小,Cu2O与H+反应慢 SO42- Cu(OH)2+SO2=Cu+H2SO4 不能。因为NO2溶于水生成HNO3具有强氧化性,将Cu2O直接氧化成Cu(NO3)2,溶液呈蓝色,且无紫红色固体生成。
【解析】实验Ⅰ(1)将1.5mL1.0mol/LCuSO4溶液滴入5mLl.0mol/LNaOH溶液中制得Cu(OH)2悬浊液,其方程式为:Cu2++2OH-=Cu(OH)2↓。
(2)①在制得的Cu(OH)2悬浊液中加入稍过量葡萄糖溶液,加热煮沸,产生红色沉淀,说明葡萄糖将氢氧化铜还原为氧化亚铜的红色沉淀,所以说明氢氧化铜有氧化性,葡萄糖有还原性。②这个反应的原理,能利用生成的氧化亚铜沉淀的量,来检测血液中的葡萄糖含量。
实验Ⅱ(1)洗涤沉淀的基本方法就是:向过滤器中加入蒸馏水,使蒸馏水将沉淀表面的杂质洗去,重复操作2~3即可。所以答案为:用玻璃棒引流,向过滤器中加入蒸馏水至浸没沉淀,待水流出后,按上述操作重复2~3次。
①实验中的现象为:红色固体(氧化亚铜)很快转变为紫红色固体(单质铜),溶液呈蓝色(铜离子),所以反应为:Cu2O+2H+==Cu+Cu2++H2O。
②氧化亚铜转化为单质铜和铜离子,需要在酸性条件下进行,而亚硫酸的酸性弱,氢离子较少,所以开始时反应比较慢。
③最后溶液的蓝色褪去,说明铜离子都被二氧化硫还原为单质铜了,所以二氧化硫应该被氧化为硫酸根离子。
(2)由上,新制氢氧化铜与过量SO2反应生成单质铜和硫酸根离子,所以反应为:Cu(OH)2+SO2=Cu+H2SO4。如果将表中SO2换为NO2,NO2与水反应生成具有强氧化性的硝酸,硝酸可以直接将氧化亚铜转化为硝酸铜,所以无法观察到同样的现象。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知反应:①Cl2+2KBr=2KCl+Br2, ②KClO3+6HCl=3Cl2+KCl +3H2O,
③2KBrO3+Cl2=Br2+ 2KClO3,下列说法正确的是
A. 上述三个反应都有单质生成,所以都是置换反应
B. 氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2
C. 反应②中还原剂与氧化剂的物质的量之比为6:1
D. ③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的一项是( )
A.因为Cu可以导电,所以Cu是电解质
B.因为NaHSO4可以电离出H+ , 所以属于酸
C.武德合金熔点低(70℃),可以做保险丝
D.造成酸雨的主要大气污染物是SO2和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O![]() +O2+xOH-=Fe3O4↓+S4O
+O2+xOH-=Fe3O4↓+S4O![]() +2H2O。请回答下列问题。
+2H2O。请回答下列问题。
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是____________。
(2)反应的化学方程式中x=________。
(3)每生成1 mol Fe3O4,反应转移的电子为________mol,被Fe2+还原的O2的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是__________________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入__________________。
A.硫酸钾 B.硫酸锰 C.氯化钾 D.水
II. 分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
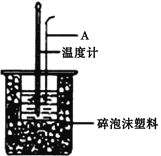
(1)仪器A的名称是__________________,烧杯间填满碎泡沫塑料的作用是__________________。
(2)加入NaOH溶液的正确操作是__________________ (填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g·℃)。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1℃ | 终止温度t2℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H=__________________(结果保留一位小数)。
(4)实验中若改用50 mL 0.50 mol/L的盐酸与40 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量__________________(填“相等”“不相等”),若实验操作均正确,则所求中和热__________________(填“相等”“不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列叙述正确的是
A. 1mol甲醇中含有C—H键的数目为4NA
B. 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA
C. 标准状况下,2.24L已烷含有分子的数目为0.1NA
D. 常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,原子序数依次增大,A、E 同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物,E2D2可用于呼吸面具或潜水艇中氧气的来源。请根据以上信息回答下列问题:
(1)BD2的电子式为___________________。
(2)EAB2D4水溶液显酸性的原因是________________________________________。
(3)等浓度的EABD3和E2BD3混合溶液中,各离子的离子浓度由大到小的顺序为________________。
(4)A、B、D、E 四种元素组成的某无机化合物,受热易分解。写出该化合物的溶液与足量的Ba(OH)2 溶液反应的离子方程式____________________________________________。
(5)常温下,测得X 和Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+浓度之比是__________。
(6)在一个装有可移动活塞的密闭容器中进行如下可逆反应:C2(g)+3A2 (g ) 2CA3(g) ΔH=-92.4 kJ·mo1-1。反应达到平衡后,测得容器中各物质的物质的量分别为C2 0.5mol、A2 0.2mol、CA3 0.2 mol,此时容器体积为1.0 L。
①实验室制备CA3的的化学方程式____________________________。
②如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将__________移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气污染物主要成分是SO2、NO2、NO、CO及可吸入颗粒等,主要来自于燃煤、机动车尾气和工业废气,会导致雾霾、酸雨等。
(1)大气污染物成分中属于酸性氧化物的是_______________________(填化学式)。
(2)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3。已知H2SO3是二元弱酸,写出反应的离子方程式:
①NaOH溶液吸收过量的SO2:_____________________________________________。
②氨水吸收过量的SO2:___________________________________________________。
(3)汽车的三元催化转化器中,在催化剂作用下NO和CO转化为无毒气体,反应的化学方程式是: 2CO+2NO ![]() 2CO2+N2
2CO2+N2
①该反应中,氧化剂是____________(填化学式),氧化产物是______________(填化学式)。
②当生成2mol N2时,转移电子的物质的量是___________________________。
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术,生成的产物都无毒。NH3还原NO2时,还原剂和氧化剂的物质的量之比是________________。
(5)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的pH=5.5,将烟气中的SO2转化为SO42―。已知0.1mol/L 100mLNaClO溶液,可以恰好吸收0.01moL SO2,则反应的离子方程式是____。
(6)SO2通过下列过程既能制得H2SO4又能制得H2。

①可循环利用的物质X是_________________(填化学式)。
②制得H2SO4的化学方程式是____________________________________。
③制得H2的化学方程式是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Na2CO3、NaHCO3和NaCl的固体混合物100g。
(1)将该混合物加热到质量不再减少为止,反应方程式为:____________________,剩下的残渣为93.8g;该混合物中有___________g NaHCO3;
(2)将所有残渣放入烧杯中,加蒸馏水溶解后,配成500mL一定物质的量浓度溶液,配制过程中必需使用的化学仪器有__________(填选项的字母)。
A.烧杯 B.500 mL容量瓶 C.漏斗 D.胶头滴管 E.玻璃棒 F.量筒
(3)量取配制好的溶液50mL,向其中加入过量盐酸至不再产生气泡,共收集到1.12L气体(标准状况)。该反应过程的离子方程式为______________;则该混合物中有_________g NaCl。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com