
【题目】开发新能源是解决环境污染的重要举措,其中甲醇、乙醇、甲烷都是优质的清洁燃料,可制作燃料电池。
(1)已知:①C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH1=-1366.8kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ/mol
③H2O(g)=H2O(l) ΔH3=-44 kJ/mol。
乙醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:______________________。
(2)可利用甲醇燃烧反应设计一个燃料电池。如下图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。
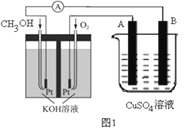
①写出燃料电池负极的电极反应式_________________。
②若利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是_______极(填“A”或“B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为________L。
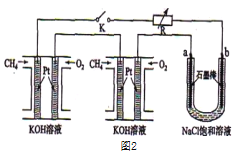
(3)某研究小组将两个甲烷燃料电池串联后如上图2作为电源,进行饱和氯化钠溶液电解实验若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量表达式为_____________(法拉第常数F=9.65×l04C/ mol),最多能产生的氯气体积为_____L(标准状况)。
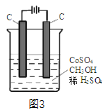
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+在阳极氧化成Co3+,生成的Co3+将甲醇氧化成CO2和H+(用石墨烯除去Co2+),现用如图3所示装置模拟上述过程,则Co2+在阳极的电极反应式为________________________除去甲醇的离子方程式为______________________________。
【答案】 C2H5OH(l)+2O2(g)=2CO(g)+3H2O(l) ΔH1=-932.8kJ/mol CH3OH-6e-+ 8OH-=CO32-+6H2O B 1.12 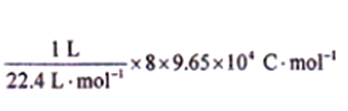 4 Co2+-e-=Co3+(或6Co2+-6e-=6Co3+) 6Co3++CH3OH+H2O=6Co2++CO2↑+6H+
4 Co2+-e-=Co3+(或6Co2+-6e-=6Co3+) 6Co3++CH3OH+H2O=6Co2++CO2↑+6H+
【解析】(1)已知:①C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH1=-1366.8kJ/mol,②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ/mol,③H2O(g)=H2O(l) ΔH3=-44 kJ/mol。
乙醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:由盖斯定律方程式①-②+③×3得到C2H5OH(l)+2O2(g)=2CO(g)+3H2O(l) ΔH1=(-1366.8kJ·mol-1)-(-566kJ·mol-1)+(-44kJ·mol-1)×3=--932.8kJ/mol。(2)①CH3OH作还原剂,失电子,燃料电池负极的电极反应式:CH3OH-6e-+ 8OH-=CO32-+6H2O;②若利用该燃料电池提供电源,与图1右边烧杯相连,B与电池的负极相连,是阴极,A是阳极;在铁件表面镀铜,则铁件应是阴极,故选B。根据得失电子守恒:2Cu~O2,当铁件的质量增重6.4g时,燃料电池中消耗氧气6.4g/(2×64g·mol-1)== 0.05mol,标准状况下体积为22.4L·mol-1×0.05mol=1.12L;(3)根据得失电子守恒,可得:1 mol CH4~8 mol e-~4 mol Cl2,故若每个电池甲烷通入量为1 L(标准状况),生成4L Cl2;电解池通过的电量为![]() ×8×9.65×l04C·mol-1=3.45×104C(题中虽然有两个燃料电池,但电子的传递量只能用一个池的甲烷量计算)。(5)通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
×8×9.65×l04C·mol-1=3.45×104C(题中虽然有两个燃料电池,但电子的传递量只能用一个池的甲烷量计算)。(5)通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。


科目:高中化学 来源: 题型:
【题目】(14分)某化工厂以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2。
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:
MnO2 + FeS + H2SO4![]() MnSO4 + Fe2(SO4)3 + S + H2O
MnSO4 + Fe2(SO4)3 + S + H2O
(2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按以下的工业流程进行操作处理得溶液(IV),电解溶液(IV)即得MnO2和Zn。
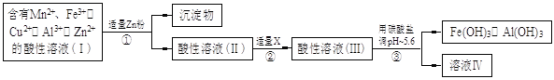
a.操作①中加Zn粉后发生反应的离子方程式为 。
b.操作②中加入适量X的作用是什么 ;X的首选物的化学式是 。
c.操作③中所加碳酸盐的化学式是 。
(3)为了从上述流程中产生的Fe(OH)3、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如下的有关流程图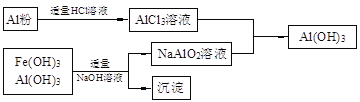
a.AlCl3溶液和NaAlO2溶液反应生成AI(OH)3的离子方程式为 ,若总共得到n molAl(OH)3,则消耗的NaOH和HCl的理论量(mol)分别为 、 。
b.若使用下列流程回收处理,请比较两个流程消耗酸碱的用量?
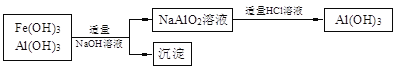
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质与条件已略去,其中反应②的条件是“700℃,催化剂”).G是常见的红色金属单质,B、H是空气的主要成分,A、C、E均是常见气体,D是最常见的无色液体. 
请回答下列问题:
(1)E的化学式为 .
(2)A的电子式为 .
(3)写出反应①的离子方程式: .
(4)写出反应②的化学方程式,并标出电子转移的方向与数目: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用A+、B﹣、C2﹣、D、E、F分别表示含有18个电子的几种微粒(离子或分子),请回答下列问题:
(1)A元素是________、B元素是________、C元素是________(用元素符号表示).
(2)D是由两种元素组成的双原子分子,用电子式表示其形成过程________.
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是________,其与水反应的化学方程式为________.
(4)F分子中含有6个原子,其化学式是________或________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关电解质溶液的说法正确的是
A. 0.1mol·L-1 Na2SO3溶液加水稀释,c(H+)∶c(SO![]() )的值逐渐减小
)的值逐渐减小
B. pH为6的碳酸溶液,水电离出的c(H+)=1.0×10-6mol·L-1
C. pH为12的氢氧化钡溶液与pH为2的盐酸溶液等体积混合,溶液呈碱性
D. 把0.2mol·L-1醋酸与0.1mol·L-1醋酸钠溶液等体积混合c(CH3COOH)+c(CH3COO-)=3c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
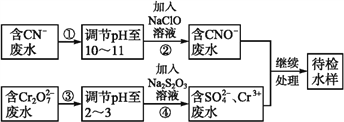
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为_______________。
(2)步骤④的反应为S2+Cr2O72-+H+![]() SO42-+Cr3++H2O(未配平), 则每消耗0.4 molCr2O72-转移转移____mol e-。
SO42-+Cr3++H2O(未配平), 则每消耗0.4 molCr2O72-转移转移____mol e-。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是_________________。
(4)在25 ℃下,将a mol·L-1的NaCN溶液与0.01 mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,用含a的代数式表示HCN的电离常数Ka=____。若25 ℃时将浓度均为0.1 mol·L-1的NaCN、HCN溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是____(填字母)。
a.此溶液一定有c(Na+)+c(H+)=c(OH-)+c(CN-)
b.此溶液一定有c(Na+)=c(HCN)+c(CN-)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大
(5)除去废水中的阳离子:取水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入一定量的Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程式为_______、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯M,常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。M属于芳香族化合物,苯环上只含有一个直支链,能发生加聚反应和水解反应。测得M的摩尔质量为162g·mol-1,只含碳、氢、氧,且原子个数之比为5:5:1。
(1)肉桂酸甲酯的结构简式是______________________。
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如下图所示(图中球与球之间连线表示单键或双键)。G的结构简式为_________________。
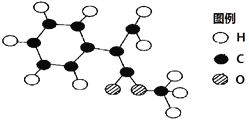
(3)用芳香烃A为原料合成G的路线如下:
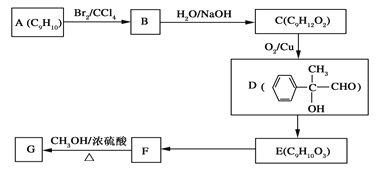
①化合物E中的官能团有________(填名称)。
②E→F的反应类型是________,
F→G的化学方程式为__________________________________________________。
③写出两种符合下列条件的F的稳定的同分异构体的结构简式_________________。
ⅰ.分子内含苯环,且苯环上只有一个支链;
ⅱ.在催化剂作用下,1mol该物质与足量氢气充分反应,最多消耗5mol H2;
ⅲ.它不能发生水解反应,但可以发生银镜反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期的主族元素,原子序数依次增大,A是IA族的非金属元素,B元素的最高价氧化物的水化物与其简单气态氢化物可反应生成盐,C是短周期中原子半径最大的元素,D元素原子L层电子数和M层电子数之差等于B元素最外层电子数,E元素最高正价和最低负价代数和等于4,据此回答下列问题:
(1)F元素在周期表中的位置__________,C原子结构示意图______________。
(2)A、B两元素可形成18电子的分子,该分子的电子式为_______________。
(3)A和氧元素形成的简单化合物,其熔沸点高于A和E形成的简单化合物,原因是____________。
(4)C、D、F可形成复杂化合物C[DF4],该化合物含有的化学键类型为________________。
(5)仅有上述元素形成的化合物或单质间的某些反应,可用以说明E和F两元素非金属性的强弱,写出其中一个离子反应方程式__________________________________。
(6)写出C、D两元素最高价氧化物的水化物反应的离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同状况下的12C18O和14N2两种气体,下列说法正确的是( )
A.若分子数相等,则体积相等
B.若原子数相等,则中子数相等
C.若质量相等,则质子数相等
D.若体积相等,则质量数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com