
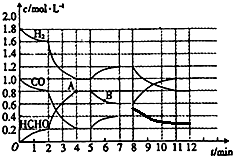
 甲醛是一种重要的有机原料,主要用于塑料工业、医药等.工业上可用如下方法合成甲醛:CO(g)+H2(g)?HCHO(g)△H<0.如图为一定条件下,上述反应的变化状况.
甲醛是一种重要的有机原料,主要用于塑料工业、医药等.工业上可用如下方法合成甲醛:CO(g)+H2(g)?HCHO(g)△H<0.如图为一定条件下,上述反应的变化状况.| △c |
| △t |
| c(HCHO) |
| c(CO)?c(H2) |
| 0.6 |
| 0.4×1.2 |
| △c |
| △t |
| 0.8mol/L-0.2mol/L |
| 4min-2min |
 ,故答案为:
,故答案为: .
.


科目:高中化学 来源: 题型:
| A、将pH试纸放入溶液中,观察其颜色变化并与标准比色卡对照 |
| B、将溶液倒在pH试纸上,观察其颜色变化并与标准比色卡对照 |
| C、用干燥、洁净玻璃棒蘸取溶液,滴在pH试纸上,观察其颜色变化并与标准比色卡对照 |
| D、在试管内放入少量溶液并煮沸,把pH试纸放在管口观察其颜色并与标准比色卡对照 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.
某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.
| ||
| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 500 | 4 | 8 | 3.2 | 4 |
| 2 | 750 | 2 | 4 | 0.8 | 3 |
| 3 | 750 | 2 | 4 | 0.8 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向蔗糖中加入浓硫酸发生一系列反应,浓硫酸主要体现吸水性和酸性 |
| B、“半成品碳”是碳元素的一种新单质,与C60都是碳元素的同素异形体 |
| C、蔗糖的水解产物之一在碱性条件下加热,可与银氨溶液反应 |
| D、焦糖烯是一种新型的烯烃,其能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N | B、M | C、X | D、Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
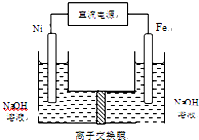 高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示.下列说法正确的是( )
高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示.下列说法正确的是( )| A、铁是阳极,电极反应为Fe-2e-+2OH-═Fe(OH)2 |
| B、电解一段时间后,镍电极附近溶液的pH减小 |
| C、每制得1mol Na2FeO4,理论上可以产生67.2L气体 |
| D、若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24L乙烯和丙烯等物质的量混合气体中含有的共用电子对的数目为0.75NA | ||||
| B、室温下,pH=13的NaOH溶液中,OH-离子的数目为0.1 NA | ||||
| C、1.8g重水(D2O)中含有的质子数和电子数均为1.0NA | ||||
D、5NH4NO3
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、I-、ClO-、Na+ |
| B、Ag+、NO3-、Cl-、K+ |
| C、K+、Na+、Ca2+、CO32- |
| D、Cu2+、Fe2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com