
| A. | 它只有一种氧化物Cs2O | B. | 它与水剧烈反应 | ||
| C. | Cs+具有很强的氧化性 | D. | CsHCO3受热不易分解 |
分析 Cs位于第六周期第IA族,属于碱金属族元素,其金属性大于Na,
A.Cs能和氧气反应生成复杂的含氧化合物;
B.金属的金属性越强,其与水或酸反应越剧烈;
C.元素的金属性越强,其简单阳离子的氧化性越弱;
D.碱金属族碳酸氢盐不稳定,受热易分解.
解答 解:Cs位于第六周期第IA族,属于碱金属族元素,其金属性大于Na,
A.金属性Cs>Na,Na和氧气反应都生成过氧化钠,则Cs能和氧气反应生成复杂的含氧化合物,故A错误;
B.金属的金属性越强,其与水或酸反应越剧烈,金属性Cs>Na,Na和水反应较剧烈,则Cs和水反应更剧烈,故B正确;
C.元素的金属性越强,其简单阳离子的氧化性越弱,金属性Cs>Na,所以Cs+没有很强的氧化性,故C错误;
D.碱金属族碳酸氢盐不稳定,受热易分解,所以CsHCO3受热易分解,故D错误;
故选B.
点评 本题以Cs为例考查碱金属元素性质递变规律,侧重考查元素周期律及学生知识迁移能力,知道金属的金属性强弱判断方法,采用知识迁移及对比的方法进行解答即可,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,在水中碳酸钠的溶解度小于碳酸氢钠的溶解度 | |
| B. | 氧化钠和过氧化钠都能与二氧化碳反应,生成物完全相同 | |
| C. | 碳酸氢钠固体中混有少量碳酸钠,可用加热的方法除去 | |
| D. | 质量相等的碳酸钠和碳酸氢钠分别与足量盐酸反应,后者产生气体多 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
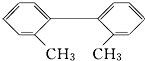 已知C-C键可以绕键轴自由旋转,对于结构简式为如图所示的烃,下列说法中正确的是( )
已知C-C键可以绕键轴自由旋转,对于结构简式为如图所示的烃,下列说法中正确的是( )| A. | 分子中至少有8个碳原子处于同一平面上 | |
| B. | 分子中至少有9个碳原子处于同一平面上 | |
| C. | 该烃苯环上的一氯取代物最多有四种 | |
| D. | 该烃是苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当n(Na)=n(Mg)=n(Al)=1mol时,①成立 | B. | 当n(Na)=n(Mg)=n(Al)=0.8mol时,②成立 | ||
| C. | 当n(Na)=n(Mg)=n(Al)=0.6mol时,③成立 | D. | 当n(Na)=n(Mg)=n(Al)=0.5mol时,④成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子里碳氢原子个数比为1:2 | |
| B. | 丙烯完全燃烧生成的CO2和H2O的物质的量相等 | |
| C. | 丙烯容易与溴水发生加成反应,且1mol乙烯完全加成消耗1mol溴单质 | |
| D. | 丙烯能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
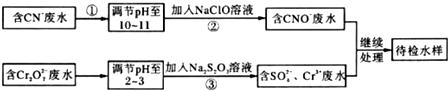
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9 mol/L | B. | 8 mol/L | C. | 5 mol/L | D. | 10 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将明矾加入海水中静置过滤是海水淡化的方法之一 | |
| B. | 海水晒盐的过程发生复分解反应 | |
| C. | 海水中提取镁的过程不涉及氧化还原反应 | |
| D. | 从海水中提取铀等微量元素是海水资源综合利用研究方向之一 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com