
����Ŀ��A�dz������л����ʣ���������ˮ����������ζ��B�IJ����ɺ���һ������ʯ�ͻ�����չ��ˮƽ���й����ʵ�ת����ϵ��ͼ����ʾ����ش��������⣺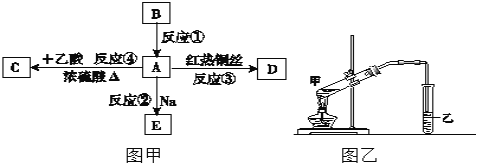
��1��B�ĽṹʽΪ______��D���ʵ�������______��
��2���ڢ١��ܷ�Ӧ�У����ڼӳɷ�Ӧ����______���Ӧ��ţ���
��3��д�����з�Ӧ�Ļ�ѧ����ʽ����Ӧ��______����Ӧ��______��
��4��ʵ������ͼ����ʾװ�ý��з�Ӧ��
a����Ӧ�ܵĻ�ѧ����ʽ��______����Ӧ����Ϊ______
b���Թ�����Ӧ����______�����еĵ��ܲ������뵽Һ���µ�ԭ����______��
c��ʵ����ɺ��Թ����з�����л���C�ķ�����______��
���𰸡� ![]() ��ȩ �� 2C2H5OH+2Na��2C2H5ONa+H2�� 2C2H5OH+O2
��ȩ �� 2C2H5OH+2Na��2C2H5ONa+H2�� 2C2H5OH+O2![]() 2CH3CHO+2H2O C2H5OH+CH3COOH
2CH3CHO+2H2O C2H5OH+CH3COOH![]() CH3COOC2H5+H2O ȡ����Ӧ ����̼������Һ��Na2CO3��Һ ��ֹ���� ����ֹ����Һ ��
CH3COOC2H5+H2O ȡ����Ӧ ����̼������Һ��Na2CO3��Һ ��ֹ���� ����ֹ����Һ ��
��������B�IJ����ɺ���һ������ʯ�ͻ�����չ��ˮƽ����B��CH2=CH2��A�dz������л����������ˮ����������ζ��A�ܺ�ͭ˿��Ӧ����D��A�ܺ����ᷴӦ����C��A�ܺ��Ʒ�Ӧ����E����AΪCH3CH2OH��CΪCH3COOCH2CH3��DΪCH3CHO��EΪCH3CH2ONa����
��1��B����ϩ����ṹʽΪ![]() ��D����ȩ����2���ڢ١��ܷ�Ӧ�У����ڼӳɷ�Ӧ���Ǣ٣���3����Ӧ��Ϊ�Ҵ����Ƶķ�Ӧ����Ӧ����ʽΪ��2C2H5OH+2Na��2C2H5ONa+H2������Ӧ��Ϊ�Ҵ��Ĵ�������Ӧ����Ӧ����ʽΪ��2C2H5OH+O2
��D����ȩ����2���ڢ١��ܷ�Ӧ�У����ڼӳɷ�Ӧ���Ǣ٣���3����Ӧ��Ϊ�Ҵ����Ƶķ�Ӧ����Ӧ����ʽΪ��2C2H5OH+2Na��2C2H5ONa+H2������Ӧ��Ϊ�Ҵ��Ĵ�������Ӧ����Ӧ����ʽΪ��2C2H5OH+O2![]() 2CH3CHO+2H2O����4��a���÷�Ӧ��������������ȡ����Ӧ����ʽΪC2H5OH+CH3COOH
2CH3CHO+2H2O����4��a���÷�Ӧ��������������ȡ����Ӧ����ʽΪC2H5OH+CH3COOH![]() CH3COOC2H5+H2O��b��ʵ�����ñ���̼������Һ����������������������ʢ�ŵ��DZ���̼������Һ������������Ҵ���ˮ���ܣ�������еĵ��ܲ������뵽Һ���µ�ԭ���Ƿ�ֹ������c����������������ˮ�����Բ��÷�Һ�������룬����뷽��Ϊ����ֹ����Һ��
CH3COOC2H5+H2O��b��ʵ�����ñ���̼������Һ����������������������ʢ�ŵ��DZ���̼������Һ������������Ҵ���ˮ���ܣ�������еĵ��ܲ������뵽Һ���µ�ԭ���Ƿ�ֹ������c����������������ˮ�����Բ��÷�Һ�������룬����뷽��Ϊ����ֹ����Һ��


 ������ҵ��ͬ����ϰ��ϵ�д�
������ҵ��ͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڼ�������ʵ�������������ȷ����(����)
A. ��ﮡ���ܶ������� B. ���ơ��ء�����ֵ����У�蘆��۵����
C. 卑��ܶȱȼش��۵�ȼظ� D. �����յ��۵�Ƚ����Ƶ��۵��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ڱ���µ����������6.72LCH4 ��3.01��1023��HCl���ӡ���13.6��H2S��0.2molNH3����Ӧ�������д���пհף�
��1�������������
��2��ԭ������������
��3��������������
��4������ԭ�������ٵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ʹ���Ը��������Һ��ɫ����( )
A. ���� B. �Ҵ� C. �������� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С���Լױ�Ϊ��Ҫԭ�ϣ���������·�ߺϳ�ҽҩ�м���F��Y��
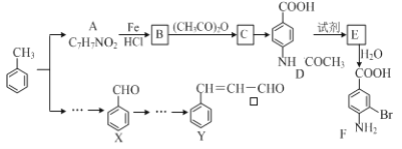
��֪����![]()
![]()
![]()
��![]()
��CH3COOH+CH3COOH��(CH3CO)2O+H2O
��ش��������⣺
��1�������й�F��˵����ȷ����______________��
A������ʽ��C7H7NO2Br B��F������HCl������NaOHӦ������
C���ܷ���ȡ����Ӧ�����۷�Ӧ D��1 mol�� F�����Ժ�2 mol NaOH��Ӧ
��2��C�� D�ķ�Ӧ������ _____��
��3���ںϳ�F�Ĺ����У�B��C���費��ʡ�ԣ�������_____________________��
��4��D��E��Ӧ������Լ��� ___________________��
��5��д��ͬʱ��������������A��ͬ���칹��Ľṹ��ʽ��д������1����_________________��
�ٱ�����ֻ�����ֲ�ͬ��ѧ��������ԭ�Ӣڷ����к��У�CHO
��6��������֪��Ϣ����X����ϩΪԭ�Ͽɺϳ�Y������ƺϳ�·�ߣ����Լ����ܼ���ѡ����___________ ע���ϳ�·�ߵ���д��ʽ��������ʾ������ͼ��
![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Сҩ���г���ҩ�����õ��������������
A.����������������Ƹ�ð
B.��������������ֹʹ
C.��˾ƥ���������Ƚ�ʹ
D.θ��ƽ��������ֹθʹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������MgSO4��Al2��SO4��3�Ļ����Һ����֪����Al3+�����ʵ���Ũ��Ϊ0.4mol/L��Mg2+�����ʵ���Ũ��Ϊ0.3mol/L�������Һ��SO42�������ʵ���Ũ��Ϊ�� ��
A.0.9 mol/L
B.1.8 mol/L
C.0.7mol/L
D.0.5mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʹ1mol��ϩ������������ȫ�ӳɷ�Ӧ��Ȼ��ʹ�üӳɷ�Ӧ�IJ����������ڹ��յ������·���ȡ����Ӧ�������ĵ��������ܵ����ʵ�����
A. 3mol B. 4mol C. 5mol D. 6mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⻯�ƣ�CaH2��������һ�ִ�����ϣ��ǵ�ɽ�˶�Ա���õ���Դ�ṩ����ij��ѧС���ͬѧ����ʦ��ָ�����Ʊ��⻯�ƣ�
���������ϡ�
����Ca�IJ���������
�ٳ��»����������Ca������������Ӧ��
��Ca������ˮ�����������ҷ�Ӧ�����������ƺ����������ų��������ȣ�
��Ca+H2 ![]() CaH2�����壩
CaH2�����壩
����CaH2�IJ���������
�ٳ��£�CaH2+2H2O=Ca��OH��2+2H2���� ��CaH2Ҫ�ܷⱣ�森
��1��������ʵ�顿
��С��ͬѧ��Ƶ���ȡװ����ͼ��ʾ���̶�װ���ԣ���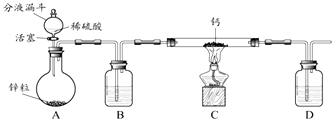
�ش��������⣺
��i��д��Ca������ˮ������Ӧ�Ļ�ѧ����ʽ�� ��
��ii��B��D����ʢ�Լ���ͬ�����Լ�Ϊ�������ƣ���D�и��Լ��������� ��
��iii��ʵ��ʱ�ȴ�A�л�����һ��ʱ����ٵ�ȼC�оƾ��ƣ���Ŀ���ǣ� ��
��2����ʵ�鷴˼��
��С��ͬѧͨ����˼������⣺�����Ƶõ�CaH2�Ƿ���
�����ٴ����ʵ����м��飬ʵ�鲽�����£�
����1�����װ�������ԣ�װ��������ˮ���ѳƺ�����Ϊm g��CaH2��Ʒ����ͼ��ʾ�����������̶�װ���ԣ���
����2����Y�ι���б��ʹA�е�ˮȫ������B�У���Ʒȫ����Ӧ����ȴ�����£���ȡ��Ͳ����ΪV mL��
��iv������ʵ�������µ�����Ħ�����ΪVm L/mol����V=mLʱ����m��Vm��ʾ���������Ƶõ�CaH2��Ʒ�Ǵ����ģ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com