
| A. | 两种物质的组成元素相同,各元素的质量分数也相同,则两者一定互为同分异构体 | |
| B. | 分子式为CnH2n的化合物,可能使酸性KMnO4溶液褪色,也可能不使其褪色 | |
| C. | 通式相同,分子组成上相差一个或若干个CH2原子团的化合物,一定互为同系物 | |
| D. | 凡含有苯环的物质都是芳香烃 |
分析 A、同分异构体是指分子式相同,但结构不同的化合物;
B、分子式为CnH2n的化合物可能是烯烃,也可能是环烷烃;
C、结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;
D、含有苯环的烃属于芳香烃,且在元素组成上只含有C、H两种元素.
解答 解:A、两种物质的组成元素相同,各元素的质量分数也相同,则最简式相同,但分子式不一定相等,如乙炔和苯,两者不是同分异构体,故A错误;
B、分子式为CnH2n的化合物可能是烯烃,也可能是环烷烃,烯烃能使酸性KMnO4溶液褪色,环烷烃不能使酸性KMnO4溶液褪色,故B正确;
C、通式相同,组成上相差一个或n个“CH2”原子团的化合物,若结构不相似,一定不是同系物,故C错误;
D、含有苯环的物质不一定属于芳香烃,如溴苯,故D错误;
故选B.
点评 本题主要考查了同分异构体、同系物的概念以及有机物的性质,难度不大,注意分子式为CnH2n的化合物可能是烯烃,也可能是环烷烃.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 滴入KSCN显红色的溶液:Na+、Cu2+、Br-、SO42- | |
| B. | 滴入酚酞显红色的溶液:Na+、Al3+、SO42-、Cl- | |
| C. | c(Fe2+)=1 mol•L-1的溶液:H+、Na+、Cl-、NO3- | |
| D. | 加入铝粉能产生大量H2的溶液:Na+、K+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同物质的量的N2和HCl的原子数相同,分子数也相同 | |
| B. | 0.05mol H2SO4含有氧原子数的精确值为1.024×1023 | |
| C. | 0.1mol氯的微粒数约为6.02×1023个 | |
| D. | 1mol NaClO含有阿伏加德罗常数个氯分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液加水稀释后,恢复至原温度,所有离子浓度均减小 | |
| B. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等 | |
| C. | pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)前者大 | |
| D. | 0.1mol•L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
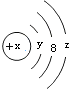
| A. | Y=2 | B. | 若X=14,它的氢化物的化学式为H2X | ||
| C. | 若X=18,则Z=8 | D. | 若X=17,它的氧化物化学式为W2O7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
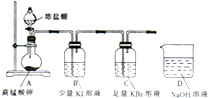 某同学设计如下实验以探究氯、溴、碘的非金属性强弱的递变规律,实验装置如图所示.已知常温下高锰酸钾与浓盐酸混合可产生氯气.
某同学设计如下实验以探究氯、溴、碘的非金属性强弱的递变规律,实验装置如图所示.已知常温下高锰酸钾与浓盐酸混合可产生氯气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SiO2、NO2均为酸性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 烧碱、冰醋酸、四氯化碳均为电解质 | D. | 汽油、水玻璃、氨水均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
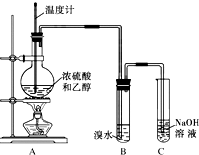 为探究乙烯的制取及乙烯和溴水反应的有关问题,甲、乙、丙三同学进行了如下实验活动,请你参与他们的活动并回答相关问题.
为探究乙烯的制取及乙烯和溴水反应的有关问题,甲、乙、丙三同学进行了如下实验活动,请你参与他们的活动并回答相关问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com