
【题目】人工合成有机化合物H的路线可简单表示如下:
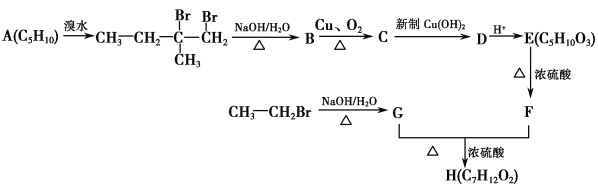
已知:F的核磁共振氢谱有四个峰,峰的面积比为1∶1∶3∶3。
请回答下列问题:
(1)A的名称(系统命名)为________;C中官能团的结构简式为____________________________。
(2)G+F―→H的反应类型为________;H的结构简式为________。
(3)C―→D的离子方程式为__________________________。
(4)E在一定条件下生成的高分子化合物的结构简式为_________________________________。
(5)X是F的同分异构体,它同时符合下列3个条件:①能发生水解反应;②不含甲基;③能发生银镜反应。则X可能的结构简式为_______________________________。
【答案】(1)2甲基1丁烯 —OH、—CHO
(2)酯化反应(或取代的反应)
CH3CH===C(CH3)COOCH2CH3
(3) +2Cu(OH)2+OH-
+2Cu(OH)2+OH-![]()
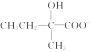 +Cu2O↓+3H2O
+Cu2O↓+3H2O
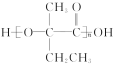
(4)
(5)HCOOCH2CH2CH===CH2、HCOO—◇或HCOOCH2—(任意两种即可)
【解析】(1)根据A与溴水加成的产物,可以推断A为![]() ,名称为2甲基1丁烯。根据图示转化关系知,C为
,名称为2甲基1丁烯。根据图示转化关系知,C为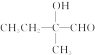 ,所含官能团为—OH、—CHO。
,所含官能团为—OH、—CHO。
(2)根据图示转化关系及已知信息知,F为![]() ,G为CH3CH2OH,F和G的反应为酯化反应(或取代反应),产物H的结构简式为
,G为CH3CH2OH,F和G的反应为酯化反应(或取代反应),产物H的结构简式为![]() 。
。
(4)E为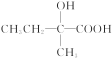 ,能发生缩聚反应生成高分子化合物
,能发生缩聚反应生成高分子化合物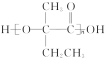
(5)根据①知,X应含有酯基,根据③知,X应含有醛基或甲酸酯基,再结合②可以推断X的结构简式可能为HCOOCH2CH2CH===CH2、HCOO—◇或HCOOCH2—。


科目:高中化学 来源: 题型:
【题目】我国规定:室内甲醛含量不得超过0.08mgm﹣3。某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛的含量,请你协助他们完成相关学习任务(部分装置如图),其反应原理及步骤如下:
4MnO4﹣+5HCHO+H+═Mn2++5CO2↑+11H2O
2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O
步骤:①量取5.00mL 1.00×10﹣3molL﹣1 KMnO4,溶液于洗气瓶中,并滴入几滴稀H2SO4,加水20mL稀释备用。
②取1.00×10﹣3molL﹣1草酸标准溶液于酸式滴定管中备用。
③用注射器抽取100mL新装修室内空气,再将注射器气体推入洗气瓶中充分反应,再重复4次。
④将洗气瓶中溶液转移到锥形瓶中(包括洗涤液),再用标准草酸溶液进行滴定,记录滴定所消耗的草酸溶液的体积。
⑤再重复实验2次(每次取高锰酸钾溶液5.00mL),3次实验消耗草酸溶液的体积平均值为12.38mL。
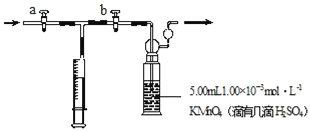
回答下列问题
(1)5.00mL高锰酸钾用_____量取。
(2)此实验用指示剂_____(填字母)。
a甲基橙 b酚酞 c淀粉 d无需另外添加试剂
(3)计算该居室内空气中甲醛的浓度_____mgm﹣3。
(4)下列操作能引起室内甲醛浓度偏高的是_____。
a.滴定终点俯视读数
b.滴定前有气泡滴定后无气泡
c.在高锰酸钾溶液中加入少量水
d.装草酸的滴定管未润洗
(5)草酸是二元中强酸,草酸氢钠溶液显酸性.常温下,如果向10 mL 0.01molL﹣1H2C2O4溶液中滴加0.01 molL﹣1NaOH溶液
①当加入的NaOH溶液体积为10mL,请你写出溶液中质子守恒关系式_____。
②当加入的NaOH溶液体积为20mL,请你写出溶液中离子的浓度大小关系_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中不属于取代反应的是( )。
A.在催化剂存在条件下苯与溴反应制取溴苯
B.苯与浓硝酸、浓硫酸混合共热制取硝基苯
C.乙烯与溴生成1,2-二溴乙烷
D.在光照条件下甲烷和氯气反应制取氯仿
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中,不正确的是( )
A.焰火的五彩缤纷是某些金属元素的性质的展现
B.SiO2可用于制造光导纤维,其性质稳定,不溶于强酸、强碱
C.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关
D.根据分散质微粒直径大小可以将分散系分为溶液、胶体和浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别在等体积等pH或等物质的量浓度的盐酸和醋酸溶液中,加入足量锌粉,氢离子浓度c(H+)及氢气的体积V(H2)(同温同压下测定)的变化图示如下,其中正确的是 ( )
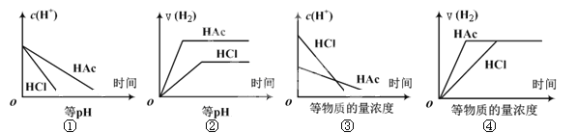
A. ①②③ B. ②④ C. ①③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 所有共价键都有方向性
B. s轨道和p轨道重叠可以形成π键
C. 若把H2S分子写成H3S分子,违背了共价键的饱和性
D. 两个原子之间形成共价键时,可形成多个σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中NO产生的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
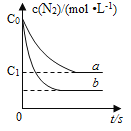
A. 温度T下,该反应的平衡常数K=![]()
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化。制备三氯化铬的流程如下图所示:
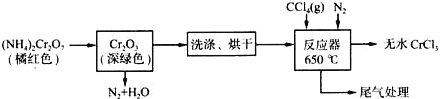
(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤,如何用简单方法判断其已洗涤干净?______________________________________________。
(2)用下图装置制备CrCl3时,反应管中发生的主要反应为: Cr2O3+3CCl4==2CrCl3+3COCl2,则向三颈烧瓶中通入N2的作用为:
①_____________________________________;②_____________________________________。

(3)样品中三氯化铬质量分数的测定:称取样品0.3000g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1g(足量)Na2O2,充分加热煮沸,适当稀释,然后加入过量2mol·L-1H2SO4至溶液呈强酸性,此时铬以Cr2O72-存在,再加入1.1g KI,加塞摇匀,充分反应后铬以Cr3+存在,于暗处静置5min后,加入1mL指示剂,用0.0250mol·L-1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL。(已知:2Na2S2O3+I2== Na2S4O6+2NaI)
①判定终点的现象是_____________;若滴定时振荡不充分,刚看到局部变色就停止滴定,则会使样品中无水三氯化铬的质量分数的测量结果_________(填“偏高”“偏低”或“无影响”)。
②加入Na2O2后要加热煮沸,其主要原因是_______________________________。
③样品中无水三氯化铬的质量分数为_________________。(保留三位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com