
| 阳离子 | K+ Na+ Fe2+ Ba2+ NH4+ |
| 阴离子 | OH- NO3- I- HSO3- AlO2- HSO4ˉ |

| ||
| ||


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
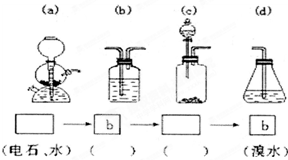 为探究乙炔与溴的加成反应,
为探究乙炔与溴的加成反应,查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2通入石灰乳中制漂白粉的离子方程式:Cl2+2OH-═Cl-+ClO-+H2O | ||
| B、利用泡沫灭火器灭火时发生的反应:2Al3++CO32-+3H2O═2Al(OH)3↓+CO2↑ | ||
| C、已知离子的还原性:Sn2+>Fe2+,则可推测在溶液中能发生如下反应:Sn4++2Fe2+═2Fe3++Sn2+ | ||
D、298 K时,已知12g石墨完全燃烧生成CO2(g)放出393.5kJ热量,1mol CO完全燃烧放出283.5kJ热量,则一定有:C(s,石墨)+
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com