
| A. |  将NO2球浸泡在冷水中和热水中 | |||||||||||||
| B. | 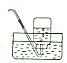 排饱和食盐水收集氯气 | |||||||||||||
| C. | 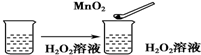 | |||||||||||||
| D. |
| |||||||||||||
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A.存在平衡2NO2?N2O4,且正反应是放热反应,升高温度,平衡向逆反应方向移动,所以气体颜色加深,可以用平衡移动原理来解释,故A正确;
B.氯气和水反应生成盐酸和次氯酸,该反应存在溶解平衡,饱和食盐水中含有氯化钠电离出的氯离子,抑制了氯气的溶解,所以用排饱和食盐水的方法收集氯气,可以用平衡移动原理来解释,故B正确;
C.过氧化氢分解,加入的二氧化锰起催化剂的作用,加快过氧化氢分解,不能用平衡移动原理解释,故C错误;
D.正反应是放热反应,温度越高K值越小,故D正确;
故选C.
点评 本题考查了平衡移动原理的使用对象,难度不大,注意使用平衡移动原理的前提必须是可逆反应.


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:填空题
 验证NH4Cl晶体中含有NH4+.将少量晶体于两端开口的硬质玻璃管中加热,如图所示.
验证NH4Cl晶体中含有NH4+.将少量晶体于两端开口的硬质玻璃管中加热,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| C. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| D. | Al2(SO4)3溶液滴加过量NaOH溶液:Al3++3OH-=Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素最高价氧化物对应水化物的酸强于硝酸 | |
| B. | 该元素最高价含氧酸的钠盐(正盐)能够促进水的电离 | |
| C. | 该元素形成的氢化物的沸点高于氨气 | |
| D. | 该元素在地壳中的含量大于硅元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16gO2和O3的混合物中O原子的电子数为8NA | |
| B. | 标准状况下,2.24L氯气与水反应,转移的电子数为0.1NA | |
| C. | 28g乙烯与丙烯混合物中含有C-H键的数目为4NA | |
| D. | 常温下,1LpH=11的Na2CO3溶液中由水电离出H+的数目为0.001NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发AlCl3溶液获得AlCl3固体 | |
| B. | 将Fe2(SO4)3溶液与NaOH溶液混合制备Fe(OH)3胶体 | |
| C. | 测定Na2CO3溶液、Na2SO3溶液的pH,比较C、S的非金属性强弱 | |
| D. | 以粗铜作阳极,纯铜片作阴极,CuCl2溶液作电解质溶液,电解精炼铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验 | 操作 |
| A | 钠与水的反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000mL的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 制取Fe(OH)3胶体 | 往盛有沸水的烧杯中滴加饱和FeCl3溶液,继续煮沸并用玻璃棒不断搅拌 |
| D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体分液漏斗上端管口倒出 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
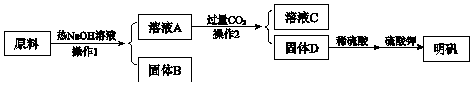
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com