



 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.1mol·L-1 | B.0.045mol·L-1 | C.0.029mol·L-1 | D.不能确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入2滴酚酞。 |
| B.用待测定的溶液润洗酸式滴定管 |
| C.用蒸馏水洗干净滴定管 |
| D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2—3cm处,再把碱式滴定管固定好,调节液面至 刻度“0”或“0”刻度以下 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 编号 | 实验 | 操作 |
| A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠, 小心放入装满水的烧杯中。 |
| B | 制备并检验氢气的可燃性 | 锌粒与稀硫酸反应产生气体,立即点燃。 |
| C | 用浓硫酸制稀硫酸 | 把水沿器壁倒入装有浓硫酸的烧杯中,并用玻璃 棒不断搅拌。 |
| D | 一氧化碳还原氧化铜 | 用石灰水检验气体产物,实验结束时先从水槽中 取出导管,再熄灭酒精灯。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
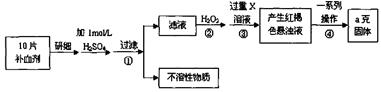
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

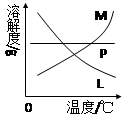
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com