
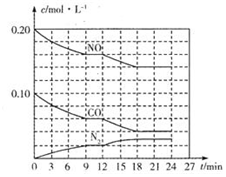
 为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.分析 (1)写出C和CO燃烧热的热化学方程式,结合盖斯定律计算所需要的热化学方程式;
(2)①分析图象浓度变化,结合反应速率概念计算V=$\frac{△c}{△t}$得到,第12min时一氧化碳和一氧化氮减小,氮气浓度增大,说明平衡正向进行,依据化学平衡移动原理分析判断选项对平衡的影响;
②依据图象分析判断,平衡状态时一氧化碳一氧化氮和氮气浓度,结合化学平衡三段式列式计算平衡百分含量和平衡常数;
(3)计算水解平衡常数Kh,再根据Ka=$\frac{Kw}{Kh}$计算.
解答 解:(1)①N2(g)+O2(g)═2NO(g)△H1=+180.5kJ•mol-1
②C的燃烧热(△H)为-393.5kJ•mol-1,热化学方程式为C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1;
③C0的燃烧热283kJ•mol-1 ,热化学方程式为CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ•mol-1;
依据盖斯定律计算③×2-①得到,2NO(g)+2CO(g)═N2(g)+2CO2(g)的△H=-746.5KJ/mol
故答案为:-746.5;
(2)①图象分析一氧化碳浓度变化=0.10mol/L-0.06mol/L=0.04mol/L,CO在0-9min内的平均反应速率v(CO)=$\frac{0.04mol/L}{9min}$=4.4×10-3,第12min时,一氧化碳和一氧化氮浓度减小,浓度增大说明平衡正向进行;
A.反应是放热反应,升高温度,平衡逆向进行,故A不符合;
B.加入NO,平衡正向进行,一氧化氮浓度大于原平衡,故B不符合;
C.加催化剂改变反应速率不改变化学平衡,故C不符合;
D.反应是放热反应,降低温度,平衡正向进行,故D符合;
改变的反应条件可能是降低温度;
故答案为:4.4×10-3;D;
②该反应在第24min时达到平衡状态,平衡浓度c(N2)=0.03mol/L,c(NO)=0.14mol/L,c(CO)=0.04mol/L,依据化学平衡三段式列式计算
2NO(g)+2CO(g)═N2(g)+2CO2(g)
起始量(mol/L) 0.2 0.1 0 0
变化量(mol/L) 0.06 0.06 0.03 0.06
平衡量(mol/L) 0.14 0.04 0.03 0.06
CO2的体积分数=$\frac{0.06}{0.14+0.04+0.03+0.06}$×100%=22.2%
平衡常数K=$\frac{0.0{6}^{2}×0.03}{0.1{4}^{2}×0.0{4}^{2}}$=3.4
故答案为:22.2%;3.4;
(3)常温下,0.1mol/L的HCOONa溶液pH为10,溶液中存在HCOO-水解HCOO-+H2O?HCOOH+OH-,故Kh=$\frac{1{0}^{-4}×1{0}^{-4}}{0.1-1{0}^{-4}}$=10-7,则HCOOH的电离常数Ka=$\frac{Kw}{Kh}$=$\frac{1{0}^{-14}}{1{0}^{-7}}$=1×10-7,故答案为:1.0×10-7.
点评 本题考查了热化学方程式书写方法,化学平衡建立,平衡状态影响因素分析,化学反应速率、平衡常数计算应用,电解质溶液电荷守恒,弱电解质电离平衡的计算应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在该温度下平衡常数K=1 | |
| B. | 平衡时通入CO气体,则再次达平衡时,H2O的转化率增大.而CO的转化率减小 | |
| C. | 平衡时CO的体积分数为25% | |
| D. | 平衡常数与反应温度无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所需仪器有:100mL容量瓶、烧杯、玻璃棒、胶头滴管、托盘天平 | |
| B. | 将量取的浓盐酸先倒入容量瓶,再加入蒸馏水至刻度线,摇匀 | |
| C. | 将溶液转移入容量瓶,要用玻璃棒引流 | |
| D. | 定容时俯视刻度,所配溶液浓度偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 实验I:实验室制备氨气 | |
| B. | 实验Ⅱ:用二氧化碳作喷泉实验 | |
| C. | 实验Ⅲ:进行中和热的测定 | |
| D. | 实验Ⅳ:电解氯化铜溶液得到铜和氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 证明“84”消毒液的氧化能力随溶液pH的减小而增强 | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 |
| B | 证明反应速率会随反应物浓度的增大而加快 | 用3 mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL 1mol•L-1CuSO4溶液,迅速产生较多气泡 |
| C | 检验Na2SO3晶体是否已氧化变质 | 将Na2SO3样品溶于稀硝酸后,滴加BaCl2溶液,观察是否有沉淀生成 |
| D | 证明同温度下氯化银的溶解度大于硫化银的溶解度 | 向2 mL0.1 mol•L-1硝酸银溶液中加入1mL0.1mol•L-1 NaC1溶液,出现白色沉淀,再加入几滴0.1 mol•L-1的Na2S溶液,有黑色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 操作及现象 | 结论 |
| A | 将重晶石浸泡在饱和碳酸钠溶液中,一段时间后固体溶解 | Ksp(BaCO3)<Ksp(BaSO4) |
| B | 二氧化硫通入溴水中,溶液颜色褪去 | 二氧化硫具有漂白性 |
| C | 向NaOH和NaNO3的混合溶液中加入铝粉并加热,将湿润的红色石蕊试纸置于管口,试纸变蓝 | NO3-还原为NH3 |
| D | 将1.0mol•L-1Na2S溶液稀释到0.10mol•L-1,测得pH变小 | 稀释后S2-的水解程度减小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y以1:1的原子个数比形成的化合物有多种 | |
| B. | W的最高价氧化物的水化物与Z的最高价氧化物的水化物之间不反应 | |
| C. | 含有元素W的盐溶液既能显酸性,也能显碱性 | |
| D. | 五种元素原子半径:Z>W>M>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠可用于制备纯碱 | |
| B. | 食品袋中常放有生石灰,能起到抗氧化剂的作用 | |
| C. | 大力推广矿物脱硫技术能减少酸雨危害 | |
| D. | 石油裂解、煤的干馏、玉米酿酒、蛋白质变性都属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
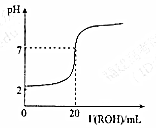 室温时,往20mL 0.1mol•L-1的HM酸溶液中逐滴滴入0.1mol•L-1的ROH碱溶液,溶液的pH与所加的ROH溶液的体积关系如图所示,下列说法正确的是( )
室温时,往20mL 0.1mol•L-1的HM酸溶液中逐滴滴入0.1mol•L-1的ROH碱溶液,溶液的pH与所加的ROH溶液的体积关系如图所示,下列说法正确的是( )| A. | V(ROH)<20mL时,随着V(ROH)增大,HM的电离程度减小 | |
| B. | K(HM)=K(ROH) | |
| C. | RM不能发生水解反应 | |
| D. | V(ROH)>20mL时,溶液中c(R+)<c(M-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com