
| A. | 热稳定性:H2Y<HZ | B. | 原子半径:W>X>Z>Y | ||
| C. | 离子半径:W2+>Y2- | D. | 碱性:XOH<W(OH)2 |
分析 短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,结合离子所带电荷,可知Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Mg元素,X为Na元素.
A.非金属性越强氢化物越稳定性;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大;
C.电子层结构相同,核电荷数越大离子半径越小;
C.金属性越强,最高价氧化物对应水化物的碱性越强.
解答 解:短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所结合离子所带电荷,可知Y、Z为非金属,处于第二周期,故Y为O元素,Z为F元素,W、X为金属处于第三周期,W为Mg元素,X为Na元素.
A.非金属性F>O,非金属性越强氢化物越稳定性,氢化物稳定性为H2O<HF,故A正确;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Na>Mg>O>F,故B错误;
C.电子层结构相同,核电荷数越大离子半径越小,所以离子半径:O2->Mg2+,故C错误;
D.金属性Na>Mg,碱性:NaOH>Mg(OH)2,故D错误;
故选A.
点评 本题考查结构与位置关系、元素周期律等,难度中等,推断元素是解题关键,注意对元素周期律的理解,可以确定元素在周期表中的相对位置,不需要确定具体元素.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
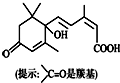
| A. | 其分子式为C15H22O4 | |
| B. | 一定条件下,l mol该有机物最多可与4 mol氢气发生加成反应 | |
| C. | 1 mol该物质与足量NaOH溶液反应,最多消耗2 mol NaOH | |
| D. | 既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将固体氢氧化钠用托盘天平直接称量 | |
| B. | 酒精灯的火焰必须用灯帽盖灭,不可用嘴吹灭 | |
| C. | 试管须用试管夹取用,且不能直接加热 | |
| D. | 用燃着的酒精灯去点燃另一个酒精灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 等浓度等体积的NaHSO3溶液与NaClO溶液混合后:c(Na++c(H+)═c(HSO3-)+c(ClO-)+2c(SO32-)+c(OH-) | |
| C. | 等浓度等体积的NaHCO3溶液与NaCl溶液混合后:$\frac{1}{2}$ c(Na+)═c(HCO3-)+c(CO32-)+c(H2CO3) | |
| D. | 标况下,将2.24LSO2气体通入到100ml 1mol•L-1的NaOH溶液中,完全反应后溶液呈酸性,则该溶液中: c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
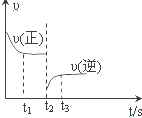 合成氨反应:N2+3H2$?_{催化剂}^{高温、高压}$2NH3 △H=-92.4kJ•mol.
合成氨反应:N2+3H2$?_{催化剂}^{高温、高压}$2NH3 △H=-92.4kJ•mol.| A. | 升高温度 | B. | 分离出部分氨气 | C. | 降低压强 | D. | 增大反应物浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯水100℃和25℃的pH值 | |
| B. | Na2CO3溶液中HCO3-和OH-数目 | |
| C. | 100mL0.1mol/L的CH3COOH溶液与10mL1.0mol/L的CH3COOH溶液中H+数目 | |
| D. | 同温下pH=11的KOH与pH=3的CH3COOH溶液中由水电离出的OH-离子浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A(g)的消耗速率与c(g)的生成速率比为2:3 | |
| B. | 由于该反应是等体积反应,所以增大压强正、逆反应速率不变 | |
| C. | 正、逆反应速率的比值是恒定的 | |
| D. | 当反应达到平衡状态时,充入一定量的A时,v正(A)增大的同时v逆(C)也增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com