
| A. | 常温常压下,活泼金属从盐酸中置换出1molH2,发生转移的电子数为2NA | |
| B. | 在常温常压下11.2L氯气所含的原子数目为NA | |
| C. | 在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为4NA | |
| D. | 62gNa2O溶于水后所得溶液中含有O2-离子数为NA |
分析 A、根据氢元素的价态由+1价变为0价来分析;
B、常温常压下,气体摩尔体积大于22.4L/mol;
C、求出硝酸镁的物质的量,然后根据1mol硝酸镁中含2mol硝酸根来分析;
D、氧化钠溶于水后和水反应.
解答 解:A、由于氢元素的价态由+1价变为0价,故生成1mol氢气转移2mol电子即2NA个,故A正确;
B、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氢气的物质的量小于0.5mol,则含有的原子数目小于NA个,故B错误;
C、溶液中硝酸镁的物质的量n=CV=2mol/L×1L=2mol,而1mol硝酸镁中含2mol硝酸根,故2mol硝酸镁中含4mol硝酸根即4NA个,故C正确;
D、氧化钠溶于水后和水反应生成氢氧化钠,所得溶液中无氧离子,故D错误.
故选AC.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 可以由下列反应合成三聚氰胺:
可以由下列反应合成三聚氰胺: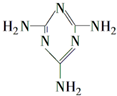 俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸
俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸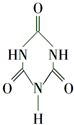 后,三聚氰酸与三聚氰胺分子相互之间通过C结合,在肾脏内易形成结石.
后,三聚氰酸与三聚氰胺分子相互之间通过C结合,在肾脏内易形成结石.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池负极发生氧化反应 | |
| B. | 原电池工作时溶液中的阳离子向正极移动 | |
| C. | 原电池工作时电子由负极沿导线流向正极,再经电解质溶液流回负极 | |
| D. | 原电池反应一定属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 1:3 | C. | 4:1 | D. | 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,HA的电离平衡常数KHA=$\frac{1}{9}$ | |
| B. | 0.01mol/LBOH溶液中阳离子浓度比c(B+):c(H+)=1010:1 | |
| C. | 0.01mol/L的两溶液中水得电离度α:α(HA)=α(BOH) | |
| D. | 溶液混合时,V1=V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 温度 物质的量 时间 | 2min | 4min | 6min | 8min | 10min | 12min |
| 450℃ | 0.2mol | 0.3mol | 0.35mol | 0.40mol | 0.50mol | 0.50mol |
| 480℃ | 0.25mol | 0.35mol | 0.45mol | 0.60mol | 0.60mol | 0.60mol |
| A. | 该反应是熵增,焓增的反应,在较高温度下能自发进行 | |
| B. | 恒温恒压,达到新平衡时,c(CO2)不变,c(MgCO3)增大 | |
| C. | 在2~8min之间CO2平均速率v(CO2)=$\frac{1}{30}$mol•L-1•min-1 | |
| D. | 升高温度,该反应平衡常数、分解速率和MgCO3分解率都增大. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com