
某温度下,浓度都是1mol•L﹣1的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的浓度分别为c(X2)=0.6mol•L﹣1,c(Y2)=0.8mol•L﹣1,c(Z)=0.4mol•L﹣1,则该反应的反应式可表示为()
A. X2+2Y2═2XY2 B. 2X2+Y2═2X2Y C. 3X2+Y2═2X3Y D. X2+3Y2═2XY3
考点: 化学反应速率和化学计量数的关系.
专题: 化学反应速率专题.
分析: 计算各物质的浓度变化量,利用浓度变化量之比等于化学计量数之比,据此确定各物质的化学计量数,再利用原子守恒用X、Y表示Z的组成,据此书写方程式.
解答: 解:t min后,△c(X2)=1mol•L﹣1﹣0.6mol•L﹣1=0.4mol•L﹣1,
△c(Y2)=1mol•L﹣1﹣0.8mol•L﹣1=0.2mol•L﹣1,
△c(Z)=0.4mol•L﹣1,
则X2、Y2、Z的化学计量数之比为=0.4mol•L﹣1:0.2mol•L﹣1:0.4mol•L﹣1=2:1:2,
故反应为2X2+Y2═2Z,根据原子守恒可知,Z为X2Y,
故反应可以表示为:2X2+Y2═2X2Y,
故选:B.
点评: 本题考查化学反应速率的有关计算,难度不大,根据物质的量浓度变化量之比等于化学计量数之比确定各物质的化学计量数是关键.


科目:高中化学 来源: 题型:
已知H2(g)+Cl2(g)═2HCl(g)的反应热(△H)等于﹣183kJ/mol,又知H﹣H键的键能为436kJ/mol,Cl﹣Cl键的键能为243kJ/mol,则H﹣Cl键的键能为()
A. 248kJ/mol B. 496kJ/mol C. 862kJ/mol D. 431kJ /mol
/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,浓度都是1mol•L﹣1的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的浓度分别为c(X2)=0.6mol•L﹣1,c(Y2)=0.8mol•L﹣1,c(Z)=0.4mol•L﹣1,则该反应的反应式可表示为()
A. X2+2Y2═2XY2 B. 2X2+Y2═2X2Y C. 3X2+Y2═2X3Y D. X2+3Y2═2XY3
查看答案和解析>>
科目:高中化学 来源: 题型:
用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜.已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H1=+64.39kJ/mol2H2O2(l)═2H2O(l)+O2(g)△H2=﹣196.46kJ/molH2(g)+ O2(g)═H2O(l)△H3=﹣285.84kJ/mol求在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H2O(l)的反应热为多少?
O2(g)═H2O(l)△H3=﹣285.84kJ/mol求在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H2O(l)的反应热为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H﹣H键的键能为436kJ/mol,O═O键的键能为498kJ/mol,根据热化学方程式H2(g)+ O2(g)═H2O(l)△H=﹣286kJ/mol,判断H2O分子中O﹣H键的键能为()
O2(g)═H2O(l)△H=﹣286kJ/mol,判断H2O分子中O﹣H键的键能为()
A. 485.5 kJ/mol B. 610 kJ/mol C. 917 kJ/mol D. 1 220 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知热化学方程式C2H2(g)+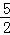 O2(g)═2CO2(g)+H2O(g)△H=﹣1256kJ/mol,下列说法正确的是()
O2(g)═2CO2(g)+H2O(g)△H=﹣1256kJ/mol,下列说法正确的是()
A. 乙炔(C2H2)的燃烧热为1256 kJ/mol
B. 若转移10 mol电子,则消耗2.5 mol O2
C. 若生成2 mol液态水,则△H=﹣2512 kJ/mol
D. 若形成4 mol碳氧共用电子对,则放出的热量为2512 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池.①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少.据此判断这四种金属活泼性由大到小的顺序是()
A. ①③②④ B. ①③④② C. ③④②① D. ③①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在1273K时发生反应Fe(s)+H2O(g)⇌FeO(s)+H2(g);现在固定容积为2.0L的密闭容器中进行该反应,试解答下列问题:
(1)其他条件不变,缩小该容器体积,反应速率增 (填“增大”、“减小”或“不变”)
(2)若降温后H2的百分含量减少,则正反应是 反应(选填“吸热”、“放热”).
(3)能判断该反应达到化学平衡状态的依据是 ;
a.混合气体的压强保持不变
b.H2的浓度不再改变
c.消耗H2O的物质的量与生成H2的物质的量之比为1:1
d.Fe、H2O、FeO、H2的物质的量之比为1:1:1:1.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com