
| A. | 溶液的pH将增大 | B. | Na+数和CO32-数的比值将变小 | ||
| C. | 溶液浓度不变,有晶体析出 | D. | 溶液浓度逐渐增大并有晶体析出 |
分析 盛有饱和碳酸钠溶液的烧杯中插入惰性电极,保持温度不变,通电时氢离子放电生成氢气,氢氧根离子放电生成氧气,即电解水,结合饱和溶液溶剂减少来解答.
解答 解:盛有饱和碳酸钠溶液的烧杯中插入惰性电极,保持温度不变,通电时氢离子放电生成氢气,氢氧根离子放电生成氧气,即电解水,
A.因温度不变,溶剂减少后还是饱和溶液,则浓度不变,pH不变,故A错误;
B.因温度不变,溶剂减少有晶体析出,溶液浓度不变,Na+数和CO32-数的比值将不变,故B错误;
C.因温度不变,溶剂减少后有晶体析出,还是饱和溶液,则溶液浓度不变,故C正确;
D.因温度不变,溶剂减少后还是饱和溶液,则浓度不变,pH不变,故D错误;
故选C.
点评 本题考查了电解及饱和溶液的浓度,注意电解水相当于饱和溶液的蒸发,明确温度不变,饱和溶液的浓度不变是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
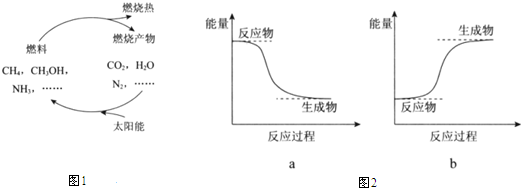
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
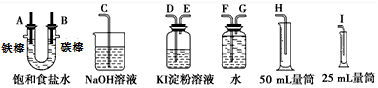
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子组成相差一个或几个CH2原子团的有机物是同系物 | |
| B. | 各组成元素质量分数相同的烃是同一种烃 | |
| C. | 分子式相同而结构式不同的有机物一定是同分异构体 | |
| D. | 具有相同通式且相差一个或若干个CH2原子团的有机物一定是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ω}{5}$ g•mol-1 | B. | 2ωg | C. | 2ω g•mol-1 | D. | 4ω g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将含硫酸的废液倒入水槽,用水冲入下水道 | |
| B. | 对医用酒精进行蒸馏操作可得到更高纯度的酒精溶液 | |
| C. | 加热高锰酸钾固体制取并收集氧气结束后,应立即停止加热 | |
| D. | 蒸馏实验时,冷水应从上口进下口出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷光照下能与浓盐酸发生取代反应 | |
| B. | 乙烯可以用作生产食品包装材料的原料 | |
| C. | 乙醇室温下在水中的溶解度大于溴乙烷 | |
| D. | 乙酸和甲酸甲酯互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 9 | C. | 12 | D. | 15 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组的学生用标准浓度的氢氧化钠溶液测定未知浓度的盐酸溶液.
某研究性学习小组的学生用标准浓度的氢氧化钠溶液测定未知浓度的盐酸溶液.| 序号 | 选用指示剂 | 选用滴定管 |
| A | 石蕊 | (乙) |
| B | 甲基橙 | (甲) |
| C | 酚酞 | (甲) |
| D | 酚酞 | (乙) |
| 试验编号 | 待测盐酸溶液体积(mL) | 滴定开始读数(mL) | 滴定结束读数(mL) |
| ① | 25.00 | 0.00 | 20.00 |
| ② | 25.00 | 1.10 | 21.30 |
| ③ | 25.00 | 0.20 | 20.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com