
从如图所示的某气体反应的能量变化分析,以下判断错误的是( )
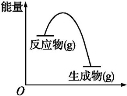
A.这是一个放热反应
B.该反应可能需要加热
C.生成物的总能量低于反应物的总能量
D.反应物比生成物更稳定
科目:高中化学 来源:2015届内蒙古赤峰市元宝山区高二上学期期末化学试卷(解析版) 题型:选择题
α1和α2分别为A在甲、乙两个恒容容器中平衡体系A(g)  2B(g)和2A(g)
2B(g)和2A(g)  C(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是( )
C(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是( )
A.α1、α2均减小 B.α1、α2均增大
C.α1减小,α2增大 D.α1增大,α2减小
查看答案和解析>>
科目:高中化学 来源:2015届云南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式的是( )
A.足量的硫酸铝溶液与纯碱溶液反应: 2A13++3CO32-+3H2O =2A1(OH)3↓+3CO2↑
B. NaHS溶液的水解方程式: HS-+H2O H3O++S2-
H3O++S2-
C. Fe(OH)3与足量的HI溶液反应: Fe(OH)3+3H+=Fe3++3H2O
D.向亚硫酸氢铵溶液中加入足量的NaOH溶液: NH4++OH-=NH3·H2O
查看答案和解析>>
科目:高中化学 来源:2015届云南省云龙县高二下学期期末考试化学试卷(解析版) 题型:选择题
A是一种常见单质,B、C为常见化合物,A、B、C均含有元素X,它们有如下图的转化关系(部分产物及反应条件已略去)。下列判断正确的是
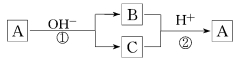
A.X元素可能为Al
B.X元素一定为金属元素
C.反应①和②一定互为可逆反应
D.反应①和②一定为氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步(人教选修4)1.1.1化学反应与能量的变化(解析版) 题型:填空题
下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
能量/kJ | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
根据上述数据回答(1)~(5)题。
(1)下列物质本身具有的能量最低的是 。
A.H2B.Cl2 C.Br2D.I2
(2)下列氢化物中,最稳定的是 。
A.HCl B.HBr C.HI
(3)X2+H2 2HX(X代表Cl、Br、I )的反应是吸热反应还是放热反应?答: 。
2HX(X代表Cl、Br、I )的反应是吸热反应还是放热反应?答: 。
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是 。
(5)若无上表中的数据,你能正确回答出问题(4)吗?
答: ,你的根据是 。
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时(人教选修4)4.4金属的电化学腐蚀与防护(解析版) 题型:选择题
下列叙述中正确的是( )
①锌跟稀硫酸反应制H2,加入少量硫酸铜溶液能加快反应速率;
②镀层破损后,白口铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀;
③电镀时,应把镀件置于电解槽的阴极;
④冶炼铝时,把氧化铝加入液态冰晶石中熔融后电解;
⑤钢铁表面常易锈蚀生成Fe2O3·nH2O。
A.①②③④⑤B.①③④⑤ C.①③⑤ D.②④
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时(人教选修4)2.2影响化学反应速率的因素(解析版) 题型:填空题
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有 ;
(2)要加快上述实验中气体产生的速率,还可采取的措施有 (答两种);
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应容器中,收集产生的气体,记录获得相同体积的气体所需时间。
实验 混合溶液 | A | B | C | D | E | F |
4 mol·L-1 H2SO4溶液/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1= ,V6= ,V9= ;
②反应一段时间后,实验A中的金属呈 色,实验E中的金属呈 色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第四章检测试卷(解析版) 题型:选择题
500 mL KNO3和Cu(NO3)2的混合溶液中c(N)= 6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(K+)为2 mol·L-1
B.上述电解过程中共转移2 mol电子
C.电解得到的Cu的物质的量为0.5 mol
D.电解后溶液中c(H+)为2 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com