
分析 (1)根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$计算;
(2)根据反应2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2计算消耗氧气体积;根据C、Na元素守恒计算出消耗氢氧化钠的物质的量,然后根据c=$\frac{n}{V}$计算出氢氧化钠的浓度.
解答 解:(1)二者含有相同的氧原子数,说明二者含有O的物质的量相等,5.6g CO中含有O的物质的量为:$\frac{5.6g}{28g/mol}$=0.2mol,则需要NO2的物质的量为:$\frac{0.2mol}{2}$=0.1mol,标况下0.1mol NO2的体积为:22.4L/mol×0.1mol=2.24L,
故答案为:2.24;
(2)2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,
56g 22.4L
5.6g V(O2)
则V(O2)=$\frac{22.4L×5.6g}{56g}$=2.24L,
将生成的气体通入100ml NaOH溶液,恰好完全反应生成Na2CO3,根据钠离子、碳元素守恒可知:n(NaOH)=2n(Na2CO3)=2n(CO)=$\frac{5.6g}{28g/mol}$×2=0.2mol,
该NaOH溶液的物质的量的浓度是:c(NaOH)=$\frac{0.2mol}{0.1L}$2mol/L,
答:5.6gCO完全燃烧消耗标况下氧气体积为2.24L;该氢氧化钠溶液的物质的量浓度为2mol/L.
点评 本题考查物质的量的计算、化学反应计算,题目难度中等,明确发生反应实质为解答关键,注意掌握物质的量与其它物理量之间的关系,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
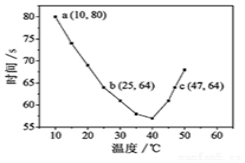 NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol•L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol•L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 不能比较图中b、c两点对应的NaHSO3反应速率的大小 | |
| C. | 图中b点对应的NaHSO3反应速率为3.125×10-4mol•L-1•s-1 | |
| D. | 温度高于40℃时,淀粉不宜用作该试验的指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g≤m≤128g | B. | 36g<m<180g | C. | 18g<m<128g | D. | 36g≤m≤128g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应容器中,气体物质的总质量不再变化 | |
| B. | 反应容器中,各物质的量不随时间变化 | |
| C. | 反应容器中,压强不随时间改变而改变 | |
| D. | 反应容器中,气体的密度不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
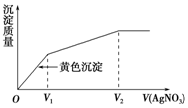 往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.则原溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$的比值为( )
往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.则原溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$的比值为( )| A. | V2-V1 | B. | $\frac{{V}_{1}}{{V}_{2}-{V}_{1}}$ | C. | $\frac{{V}_{1}}{{V}_{2}}$ | D. | $\frac{{V}_{2}}{{V}_{1}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15mL 1.5 mol•L-1的AgNO3溶液 | B. | 10mL 2 mol•L-1的NaCl溶液 | ||
| C. | 5mL 1 mol•L-1的AlCl3溶液 | D. | 5mL 1.6mol•L-1的BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入Ca(OH)2溶液,有白色沉淀生成,则溶液中一定存在CO32- | |
| B. | 加入Ba(NO3)2 溶液,生成白色沉淀,加入稀盐酸后沉淀不溶解时,可确定有SO42-存在 | |
| C. | 加入CCl4,振荡,静置,下层溶液呈紫色,则原溶液中存在碘单质 | |
| D. | 加入AgNO3溶液,生成白色沉淀,加入稀盐酸沉淀不溶解时,可确定有Cl-存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com