
分析 (1)A、C溶液的pH相同,A、C为NH4Cl溶液、盐酸;A、B溶液中水的电离程度相同,A、B为CH3COONa溶液、NH4Cl溶液.故A为NH4Cl溶液,B为CH3COONa溶液,C为盐酸,D为NaNO3溶液,溶液的pH=7;
(2)(I)任何水溶液都呈电中性,则溶液中阴阳离子所带电荷相等;
(II)任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,利用铵根离子水解使溶液显酸性来分析;
(3)在25℃时,KW=C(H+)×C(OH-)=10-14,C(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$,PH=-lgC(H+),根据AG和pH的计算公式可得AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=lg$\frac{c({H}^{+})}{\frac{1{0}^{-14}}{c({H}^{+})}}$=2(7-pH),所以pH=3的醋酸溶液的AG=2(7-3)=8.
解答 解:(1)A、C溶液的pH相同,A、C为NH4Cl溶液、盐酸;A、B溶液中水的电离程度相同,A、B为CH3COONa溶液、NH4Cl溶液,故A为NH4Cl溶液,B为CH3COONa溶液,C为盐酸,D为NaNO3溶液,溶液的pH=7,
①通过以上分析知,B是CH3COONa,C是盐酸,故答案为:CH3COONa;
②常温下若B溶液中c(OH-)与C溶液中的c(H+)相同,B溶液的pH用PHb表示,C溶液的pH用pHc表示,则pHb+pHc=-lg$\frac{1{0}^{-14}}{1{0}^{-p{H}_{b}}}$-lg10-pHc =-lg10-14=14,故答案为:14;
(2)(Ⅰ) 任何水溶液都呈电中性,则溶液中阴阳离子所带电荷相等,这几个选项中只有②中阴离子电荷之和大于阳离子电荷之和,与水溶液呈电中性相违背,故②一定不正确,故选②;
(Ⅱ)因任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,铵根离子水解方程式为NH4++H2O?NH3.H2O+H+,则c(Cl-)>c(NH4+),水解显酸性,则c(H+)>c(OH-),又水解的程度很弱,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),即①符合,
故答案为:①;
(3)在25℃时,KW=C(H+)×C(OH-)=10-14,C(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$,PH=-lgC(H+),根据AG和pH的计算公式可得AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$=lg$\frac{c({H}^{+})}{\frac{1{0}^{-14}}{c({H}^{+})}}$=2(7-pH),所以pH=3的醋酸溶液的AG=2(7-3)=8,故答案为:8.
点评 本题考查了离子浓度大小比较,明确溶液中的溶质及其性质是解本题关键,再结合电荷守恒来分析解答,题目难度中等.


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:W>Y>Z | |
| B. | X、Y与Z形成的化合物中既有极性共价键又有离子键 | |
| C. | Z与Y形成的化合物为一种高温结构陶瓷 | |
| D. | X与Y只能形成10电子分子,不能形成18电子分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
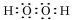 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、SO${\;}_{4}^{2-}$ | B. | Fe2+、H+、SO${\;}_{3}^{2-}$、ClO- | ||
| C. | K+、Fe3+、NO${\;}_{3}^{-}$、SCN- | D. | Mg2+、NH${\;}_{4}^{+}$、Cl-、SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com