
分析 (1)已知:①2CH3OH(g)+3O2 (g)═2CO2(g)+4H2O(g)△H=-1365.0KJ/mol
②H2(g)+$\frac{1}{2}$O2 (g)═H2O(g)△H=-241.8 KJ/mol,
根据盖斯定律:②×3-①×$\frac{1}{2}$得CO2(g)+3H2(g)=CH3OH(g)+H2O(g);
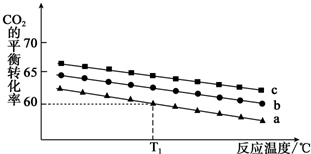
(2)①当其他条件不变时,增大反应物氢气的浓度,平衡正向移动,CO2的平衡转化率增大;
②曲线a对应的投料是n(CO2)=1mol,n(H2)=3mol,T1℃时,二氧化碳的平衡转化率为60%,转化的二氧化碳为0.6mol,容器体积为1L,则:
CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
起始浓度(mol/L):1 3 0 0
变化浓度(mol/L):0.6 1.8 0.6 0.6
平衡浓度(mol/L):0.4 1.2 0.6 0.6
再根据K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$计算平衡常数;
③由(1)知反应为放热反应,升高温度平衡逆向移动,平衡常数减小;
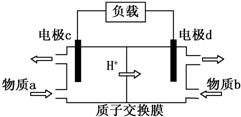
(3)①由甲醇/过氧化氢燃料电池的工作原理示意图知,氢离子移向d电极,d电极为电池的正极,发生的是还原反应;
②物质b在d电极上发生还原反应,物质b是H2O2;
③c电极为电池的负极,甲醇在该电极上反应氧化反应生成二氧化碳与氢离子.
解答 解:(1)已知:①2CH3OH(g)+3O2 (g)═2CO2(g)+4H2O(g)△H=-1365.0KJ/mol
②H2(g)+$\frac{1}{2}$O2 (g)═H2O(g)△H=-241.8 KJ/mol,
根据盖斯定律:②×3-①×$\frac{1}{2}$得:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)的反应热△H=-42.9kJ/mol,
故答案为:-42.9kJ/mol;
(2)①当其他条件不变时,增大反应物氢气的浓度,平衡正向移动,CO2的平衡转化率增大,由题给图象知相同温度下,曲线c二氧化碳的平衡转化率最大,故曲线c对应的投料是n(CO2)=1mol,n(H2)=6mol,
故答案为:n(CO2)=1mol,n(H2)=6mol;
②曲线a对应的投料是n(CO2)=1mol,n(H2)=3mol,T1℃时,二氧化碳的平衡转化率为60%,转化的二氧化碳为0.6mol,容器体积为1L,则:
CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
起始浓度(mol/L):1 3 0 0
变化浓度(mol/L):0.6 1.8 0.6 0.6
平衡浓度(mol/L):0.4 1.2 0.6 0.6
则平衡常数K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$=$\frac{0.6×0.6}{0.4×1.{2}^{3}}$=0.52,
故答案为:0.52;
③由(1)知反应为放热反应,升高温度平衡逆向移动,平衡常数减小,若500℃时,反应A的平衡常数K=2.5,T1℃高于500℃,
故答案为:高于;
(3)①由甲醇/过氧化氢燃料电池的工作原理示意图知,氢离子移向d电极,d电极为电池的正极,发生的是还原反应,故答案为:还原;
②物质b在d电极上发生还原反应,物质b是H2O2,故答案为:H2O2;
③c电极为电池的负极,甲醇在该电极上反应氧化反应生成二氧化碳与氢离子,电极反应式为:CH3OH-6e-+H2O═CO2+6H+,
故答案为:CH3OH-6e-+H2O═CO2+6H+.
点评 本题考查反应热的计算、盖斯定律、化学平衡和燃料电池,(3)中注意根据示意图中氢离子移动方向判断正负极,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 放热反应一定不需加热就可以进行 | |
| B. | 等物质的量的氢气完全燃烧生成气态水比生成液态水放热多 | |
| C. | 中和热测定时,用铁质材料代替环形玻璃搅拌器,所测中和热数值偏小 | |
| D. | S(g)+O2(g)═SO2 (g);△H1 S(s)+O2(g)═SO2 (g);△H2 △H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 起始温度T1/℃ | 终止温度T2/℃ | 温度差(T2-T1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大、增大、不变、减小 | B. | 减小、增大、不变、减小 | ||
| C. | 增大、减小、减小、减小 | D. | 增大、减小、减小、增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量是98g | |
| B. | 标况下,H2的摩尔体积是22.4L | |
| C. | 将1mol NaCl溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2mol/L | |
| D. | 氧气的摩尔质量与它的相对分子质量在数值上相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
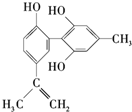 体育比赛中坚决反对运动员服用兴奋剂,倡导公平竞赛.某种兴奋剂P的结构简式如图所示,下列有关该物质的说法中正确的是( )
体育比赛中坚决反对运动员服用兴奋剂,倡导公平竞赛.某种兴奋剂P的结构简式如图所示,下列有关该物质的说法中正确的是( )| A. | 兴奋剂P遇FeCl3溶液显紫色,说明P是苯酚的同系物 | |
| B. | 兴奋剂P能使酸性KMnO4溶液的紫色褪去,说明P分子中存在碳碳双键 | |
| C. | 兴奋剂P在一定条件下可以发生取代、加成、加聚、氧化、还原、消去等反应 | |
| D. | 1mol P分别与浓溴水和H2反应时最多消耗的Br2和H2分别为4mol和7mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com