
| A. | 反应中共转移电子3mol | |
| B. | 反应中共消耗锌97.5 g | |
| C. | 气体A中SO2和H2的体积比为4:1 | |
| D. | 稀释后的溶液中c(SO42-)=1.55 mol•L-1 |
分析 Zn和浓硫酸发生:Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O,随着反应的进行,溶液浓度减小,稀硫酸与Zn发生:Zn+H2SO4(稀)=ZnSO4+H2↑,则生成的气体为SO2和的H2混合物,根据反应的有关方程式结合质量守恒定律列方程组计算.
解答 解:生成气体的物质的量为$\frac{33.6L}{22.4L/mol}$=1.5mol,溶液剩余硫酸的物质的量为$\frac{1}{2}$×2L×1mol/L=1mol,
参加反应的n(H2SO4)=0.2L×18.5mol/L-1mol=2.7mol,随着反应的进行,硫酸的浓度逐渐减小,
设反应生成xmolSO2,ymolH2,
Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O
x 2x x
Zn+H2SO4(稀)=ZnSO4+H2↑
y y y
x+y=1.5
2x+y=2.7,
解得 x=1.2,y=0.3,
所以反应生成0.3mol的H2和1.2molSO2.
A.反应中共转移电子为1.2mol×(6-4)+0.3mol×2×(1-0)=3mol,故A正确;
B.由电子守恒可知,消耗Zn为$\frac{3mol}{(2-0)}$×65g/mol=97.5g,故B正确;
C.生成0.3mol的H2和1.2molSO2,A中SO2和H2的体积比为4:1,故C正确;
D.稀释后含硫酸锌和硫酸,稀释后的溶液中c(SO42-)=$\frac{1.5mol+1mol}{2L}$=1.25mol/L,故D错误;
故选D.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中物质的量关系、电子守恒、原子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 原子晶体中,共价键的键能越大,熔沸点越高 | |
| B. | 分子晶体中,分子间作用力越大,该分子越稳定 | |
| C. | 金属阳离子只能与阴离子构成晶体 | |
| D. | 正四面体构型的分子中,键角一定为109°28′ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. |  |
| 步骤2:取适量滤液于试管中,滴加稀硫酸. | 有白色沉淀生成,说明有Ba2+; |
| 步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中 | 试管中有气泡生成,烧杯中的澄清石灰水变浑浊,结合步骤2说明沉淀是BaCO3 |
| 步骤4:取适量滤液于烧杯中,用pH计测其pH值 | pH>9.6,说明有大量的OH-,综合上面步骤可知试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,假设成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
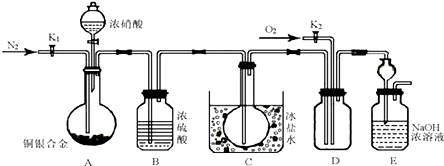
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂离子电池和碱性锌锰干电池都是二次电池 | |
| B. | 燃料电池是一种高效但是会污染环境的新型电池 | |
| C. | 化学电池的反应基础是氧化还原反应 | |
| D. | 铅蓄电池放电的时候正极是Pb,负极是PbO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要想使AlCl3溶液中的Al3+几乎全部沉淀出来,可以加入过量的氨水 | |
| B. | 向FeCl2溶液中加入氨水,最终会看到红褐色沉淀 | |
| C. | 漂白粉的有效成分是次氯酸钙 | |
| D. | 氢氧化钠、纯碱溶液要存放在带磨砂玻璃塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
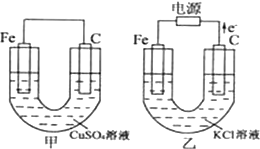 根据如图所提供的信息,在反应一段时间后:
根据如图所提供的信息,在反应一段时间后:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;中间产品C中混有反应物A和B,检验C中含有A的试剂是NaHCO3溶液.
;中间产品C中混有反应物A和B,检验C中含有A的试剂是NaHCO3溶液. .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com